W tym zadaniu podane masz konfiguracje elektronowe czterech pierwiastków chemicznych. Wiesz, że są one błędne. Wskaż błędne fragmenty i napisz, dlaczego są one nieprawidłowe.
Al: 1s22s3 2p6 3s2 3p1
Na podpowłoce 2s mogą znajdować się maksymalnie 2 elektrony
Poprawny zapis: Al: 1s22s22p6 3s2 3p1
Cu:1s22s22p63s23p64s23d9
W przypadku miedzi dochodzi do zjawiska promocji elektronowej, co powoduje przeniesienie jednego elektronu z podpowłoki 4s na podpowłokę 3d
Poprawny zapis:Cu:1s22s22p63s23p64s13d10
K:[Ne]4s1
Wybrano zły symbol chemiczny fluorowca. Powinien zostać użyty argon, ponieważ ma taką konfigurację jak rdzeń atomowy potasu.
Poprawny zapis: K:[Ar]4s1
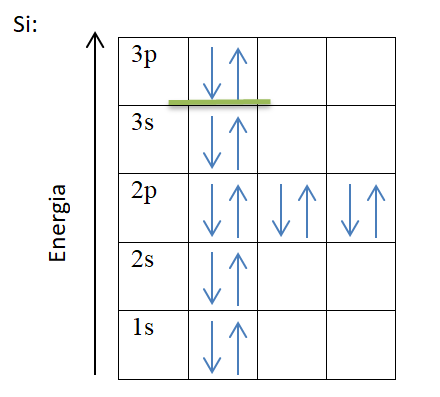
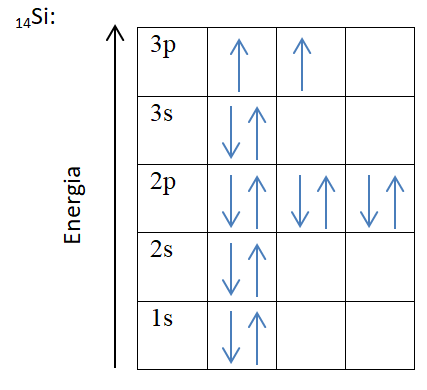
Zgodnie z regułą Hunda w atomie powinno znajdować się jak najwięcej niesparowanych elektronów, żeby uzyskać najbardziej korzystny efekt energetyczny. Elektrony ulegają sparowaniu dopiero po zapełnieniu wszystkich orbitali dla danej podpowłoki elektronowej.


Zadanie 5
18Zadanie 8
19Zadanie 10
21Zadanie 11
21Zadanie 14
22Zadanie 16
23Zadanie 27
26Zadanie 35
28Zadanie 1
33Zadanie 12
37Zadanie 14
38Zadanie 15
38Zadanie 21
40Zadanie 23
41Zadanie 1
47Zadanie 3
48Zadanie 7
50Zadanie 9
51Zadanie 11
52Zadanie 14
53Zadanie 16
54Zadanie 25.2
59Zadanie 27
59Zadanie 28
60Zadanie 7
64Zadanie 4
75Zadanie 10
77Zadanie 21
81Zadanie 22
82
