Stosunek molowy N2O5 do NO₂ wynosi 1:2, natomiast NO2 do O2 wynosi 2:1.
Przykład obliczeń dla reakcji po 100 s:
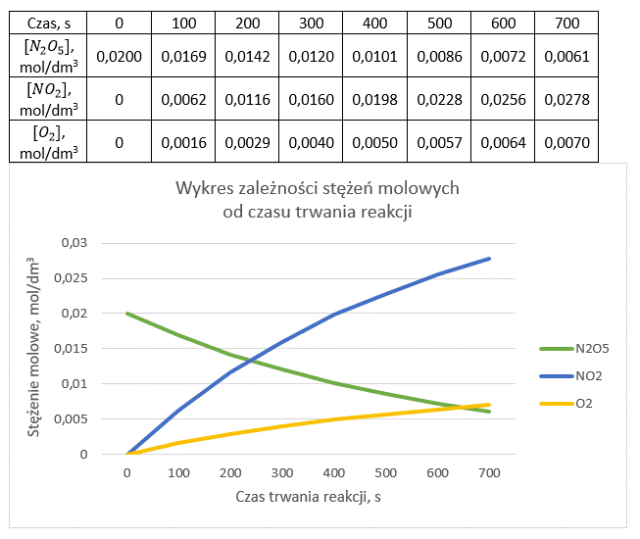
Stężenia N2O5, NO2 oraz O2 po przereagowaniu w pierwszych 100 sekundach wynoszą:
![]()
![]()
![]()
Okres półtrwania N2O5, czyli czas, po którym jego ilość zmaleje dokładnie o połowę. Czas ten wynosi około 400 s – wówczas stężenie reagenta spadnie z 0,200 [mol/dm3] (w chwili początkowej 0 s) do 0,0101 [mol/dm3] (w 400 s).

Zgodnie z równaniem reakcji stosunek molowy N2O5 do NO₂ wynosi 1:2, natomiast NO2 do O2 wynosi 2:1. Na tej podstawie można wywnioskować, że stężenie NO2 w danej chwili będzie dwukrotnie wyższe od stężenia N2O5, które uległo reakcji. Natomiast stężenie O2 będzie dwukrotnie niższe.
Przykład obliczeń dla reakcji po 100 s:
Stężenia N2O5, NO2 oraz O2 po przereagowaniu w pierwszych 100 sekundach wynoszą:
![]() (stężenie N2O5, które uległo reakcji stanowi różnicę między stężeniem początkowym, a stężeniem w danej chwili)
(stężenie N2O5, które uległo reakcji stanowi różnicę między stężeniem początkowym, a stężeniem w danej chwili)
![]() (stężenie NO2 jest dwukrotnie wyższe od stężenia N2O5)
(stężenie NO2 jest dwukrotnie wyższe od stężenia N2O5)
![]() (stężenie O2 jest dwukrotnie niższe od stężenia N2O5)
(stężenie O2 jest dwukrotnie niższe od stężenia N2O5)
Wykonujemy obliczenia zgodnie z instrukcją dla wszystkich podanych czasów.
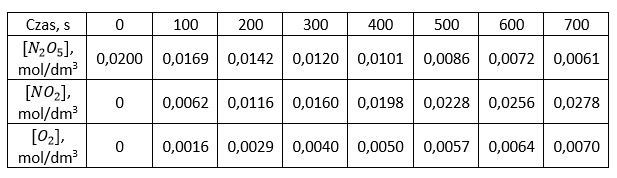
Na podstawie tabeli szkicujemy wykres zależności stężeń molowych od czasu trwania reakcji.
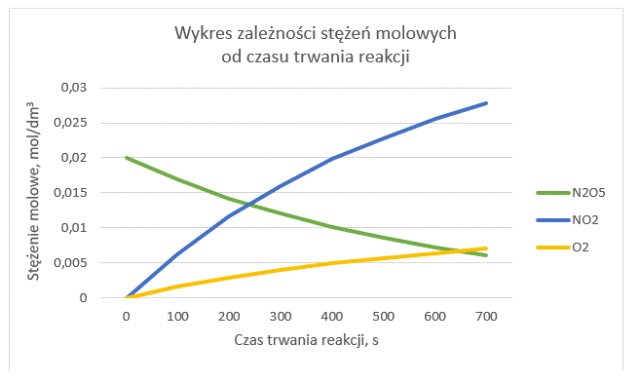
Następnie oznaczamy okres półtrwania N2O5.
Okres półtrwania czy okres połowicznego rozpadu N2O5, czyli czas, po którym ilość N2O5 zmaleje dokładnie o połowę. Czas ten wynosi około 400 s – wówczas stężenie reagenta spadnie z 0,200 [mol/dm3] (w chwili początkowej 0 s) do 0,0101 [mol/dm3] (w 400 s).
