Oblicz masę aspiryny zawartej w tabletce.
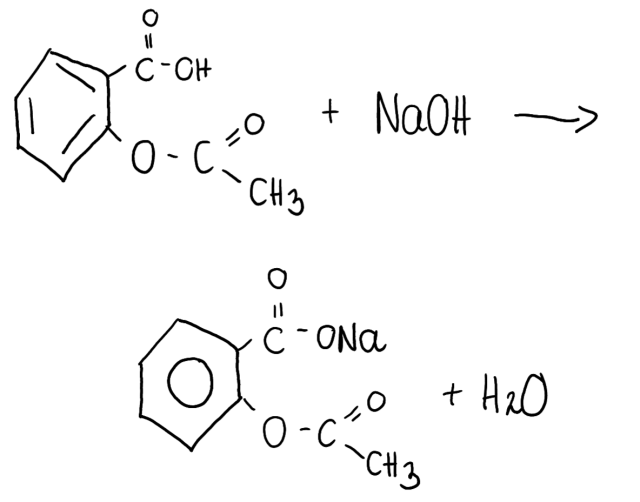
1. W pierwszej kolejności należy zapisać równanie zachodzącej reakcji chemicznej:
2. Odpowiednio przekształcając wzór na stężenie molowe należy obliczyć liczbę moli zasady, jaka wzięła udział w reakcji. Należy pamiętać, aby objętość miała odpowiednią jednostkę (dm3), zgodnie z przelicznikiem 1 dm3 = 1000 cm3:
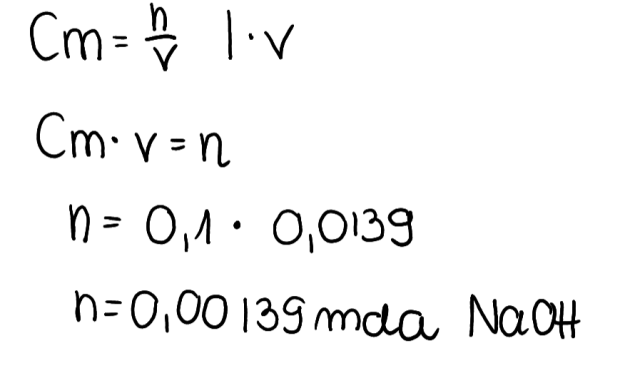
3. Z równania reakcji wiemy, że 1 mol aspiryny ważący 180g reaguje z 1 molem NaOH. Są to informacje niezbędne do sporządzenia odpowiedniej proporcji:
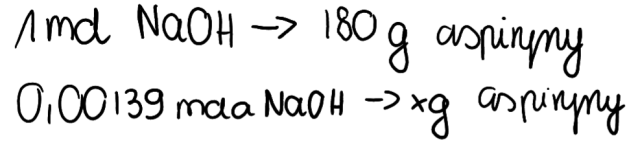
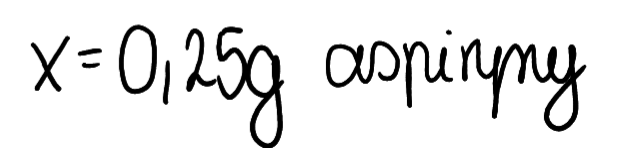


Ćwiczenie 4
203Ćwiczenie 5
203Ćwiczenie 2
208Ćwiczenie 4
208Ćwiczenie 2
222Ćwiczenie 3
222Ćwiczenie 8
222Ćwiczenie 2
226Ćwiczenie 3
226Ćwiczenie 3
233Ćwiczenie 5
233Ćwiczenie 2
251Ćwiczenie 3
264Ćwiczenie 4
264Ćwiczenie 3
268Ćwiczenie 4
268Ćwiczenie 3
278Ćwiczenie 4
278Ćwiczenie 5
296Ćwiczenie 1
304Ćwiczenie 5
304Ćwiczenie 1a
360Ćwiczenie 2a
360Ćwiczenie 3a
360Ćwiczenie 6
308Ćwiczenie 7
309Ćwiczenie 8a
361Ćwiczenie 9
309Ćwiczenie 10
309Ćwiczenie 10a
362Ćwiczenie 11
310Ćwiczenie 12
310Ćwiczenie 2
316Ćwiczenie 3
324Ćwiczenie 5
324Ćwiczenie 9
325Ćwiczenie 3
334Ćwiczenie 7
335Ćwiczenie 2
349Ćwiczenie 4
350Ćwiczenie 7
350Ćwiczenie 9
350Ćwiczenie 4
357Ćwiczenie 5
357Ćwiczenie 7
358
