W tym zadaniu oblicz masy molowe podanych związków, narysuj ich wzory półstrukturalne oraz napisz, z czego wynikają różnice w temperaturach wrzenia.
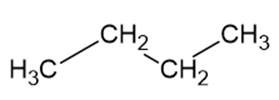
butan – M = 58 g/mol
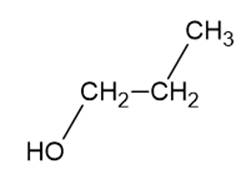
propan-1-ol – M = 60 g/mol
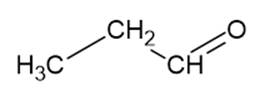
propanal – M = 58 g/mol
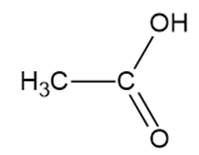
kwas octowy – M = 60 g/mol
Mimo że te związki mają zbliżone masy molowe, to butan ma najniższą temperaturę wrzenia, ponieważ jako jedyny nie tworzy wiązań wodorowych. Aldehydy nie tworzą wiązań wodorowych pomiędzy sobą, ale tworzą wiązania wodorowe z wodą, dlatego temperatura wrzenia jest większa niż butanu.
Alkohol tworzy wiązania wodorowe zarówno z wodą, jak i z drugą cząsteczką (tak samo jak kwasy karboksylowe), ale kwasy karboksylowe tworzą silniejsze wiązania wodorowe, więc temperatury wrzenia są wyższe.


Ćwiczenie 2
144Ćwiczenie 3
145Ćwiczenie 4
146Ćwiczenie 5
146Ćwiczenie 6
152Zadanie 1
158Zadanie 2
159Zadanie 3
159Zadanie 7
160Ćwiczenie 1
163Ćwiczenie 3
163Ćwiczenie 4
170Zadanie 1
174Zadanie 2
174Zadanie 3
175Zadanie 6
175Zadanie 7
175Ćwiczenie 2
179Zadanie 1
187Zadanie 4
188Ćwiczenie 2
191Ćwiczenie 3
193Ćwiczenie 4
195Ćwiczenie 5
191Zadanie 1
197Zadanie 2
197Zadanie 4
198Zadanie 6
198Ćwiczenie 1
203Ćwiczenie 2
203Ćwiczenie 3
203Zadanie 2
210Zadanie 3
211Zadanie 5
211Zadanie 6
211Zadanie 7
211Ćwiczenie 2
220Zadanie 2
222Zadanie 3
222Ćwiczenie 2
226Ćwiczenie 3
226Ćwiczenie 5
228Ćwiczenie 6
228Zadanie 1
231Zadanie 5
232Zadanie 6
232Zadanie 7
232Zadanie 5
240Zadanie 7
240Ćwiczenie 1
242Zadanie 3
244Ćwiczenie 1*
248Ćwiczenie 2*
248Zadanie 1*
252Ćwiczenie 7
252Pytanie 13
259Pytanie 15
259Pytanie 16
260
