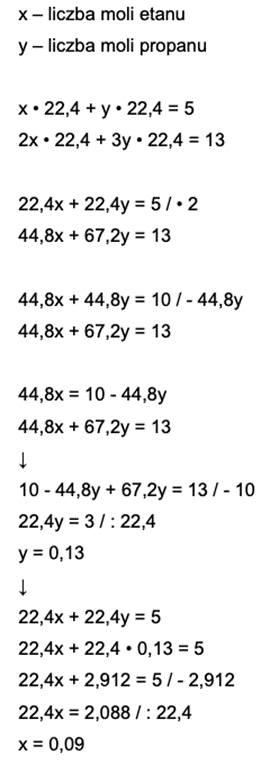
0,13 mol + 0,09 mol = 0,22 mol
%etanu = 0,09 : 0,22 ∙ 100 = 40,9 [%]
%propanu = 0,13 : 0,22 ∙ 100 = 59,1 [%]
Odpowiedź: W mieszaninie było 40,9% obj. etanu i 59,1% obj. propanu.

Krok 1: Zwróć uwagę na równania reakcji.
2C2H6(g) + 7O2(g) → 4CO2(g) + 6H2O(g)
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g)
Na podstawie równań widzimy, że 2 mole etanu dają 4 mole dwutlenku węgla, a 1 mol propanu daje 3 mole dwutlenku węgla. Zatem jeśli za liczbę moli etanu przyjmiemy x, a za liczbę moli propanu przyjmiemy y, otrzymujemy:
2 mol etanu — 4 mol dwutlenku węgla
x etanu — 2x dwutlenku węgla,
oraz:
1 mol propanu — 3 mol dwutlenku węgla
y etanu — 3y dwutlenku węgla.
W warunkach normalnych 1 mol gazu zajmuje objętość 22,4 dm3. Układamy równanie dla produktów:
x ∙ 22,4 + y ∙ 22,4 = 5
Następnie układamy równanie dla dwutlenku węgla:
44,8x + 67,2y = 13
Powstał układ równań.
Krok 2: Działamy na pierwszym równaniu.
x ∙ 22,4 + y ∙ 22,4 = 5
22,4x + 22,4y = 5 / ∙ 2
44,8x + 44,8y = 10 / – 44,8y
44,8x = 10 – 44,8y
Wartość tę można podłożyć do drugiego równania, by je rozwiązać.
44,8x + 67,2y = 13
10 – 44,8y + 67,2y = 13 / – 10
22,4y = 3 / : 22,4
y = 0,13
Krok 3: Na podstawie obliczonego y obliczamy x:
x ∙ 22,4 + y ∙ 22,4 = 5
22,4x + 22,4 ∙ 0,13 = 5
22,4x + 2,912 = 5 / – 2,912
22,4x = 2,088 / : 22,4
x = 0,09
Krok 4: Wiemy, że mamy 0,13 mol propanu i 0,09 mol etanu. Liczymy sumaryczną liczbę moli:
0,13 mol + 0,09 mol = 0,22 mol
Krok 5: Liczymy zawartość procentową według wzoru:
%X = ilość X : ilość mieszaniny ∙ 100%
Znane wartości podstawiamy do wzoru dla każdego z gazów.
%etanu = 0,09 : 0,22 ∙ 100 = 40,9 [%]
%propanu = 0,13 : 0,22 ∙ 100 = 59,1 [%]