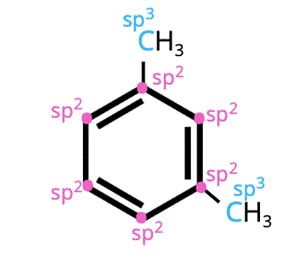

Hybrydyzacja orbitali atomowych zależy od liczby wiązań pomiędzy atomami węgla. Jeśli tworzy z innym atomem węgla tylko wiązanie pojedyncze to jego hybrydyzacja to sp3. Jeśli tworzy z innym atomem węgla wiązanie podwójne to jego hybrydyzacja to sp2. Jeśli natomiast tworzy wiązanie potrójne z innym atomem węgla – sp. Spójrz na wiązania w m-ksylenie, by określić hybrydyzację. W pierścieniu benzenu jest zdelokalizowane wiązanie pi – sugeruje to hybrydyzację sp2 atomów węgla w pierścieniu. Podstawniki metylowe łączą się tylko z jednym atomem węgla poprzez wiązanie pojedyncze – stąd ich hybrydyzacja to sp3.