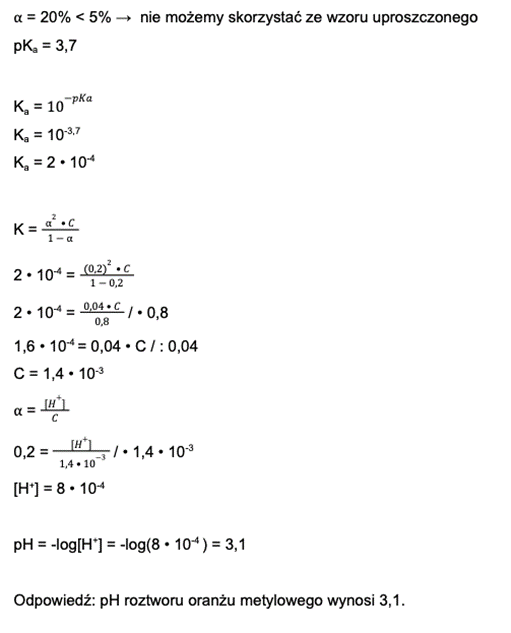

Krok 1: Zapisz dane. Informację o pKa i stopniu dysocjacji uzyskujemy z treści zadania.
α = 20% = 0,2
pKa = 3,7
Krok 2: Na podstawie pKa (czyli ujemnego logarytmu z Ka) liczymy stałą dysocjacji.
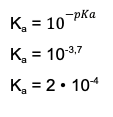
Krok 3: Według prawa rozcieńczeń Ostwalda, gdy iloraz stężenia i stałej dysocjacji K jest większy niż 400 lub, gdy stopień dysocjacji jest mniejszy niż 5%, można skorzystać ze wzoru uproszczonego na K i pominąć mianownik równania. W naszym przypadku stopień dysocjacji wynosi 20% (czyli 0,2), więc musimy korzystać ze wzoru pełnego. Podstawiamy dane do wzoru i rozwiązujemy równanie, by uzyskać wartość stężenia.
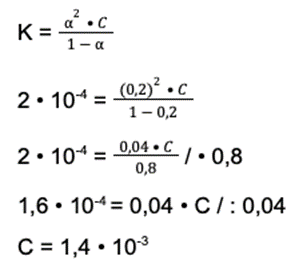
Krok 4: Mamy dostępną wartość stopnia dysocjacji i stężenie. Zastanów się, czym jest pH. Jest to wartość równa ujemnemu logarytmowi ze stężenia jonów wodorowych. Stężenie jonów H+ dostępne jest we wzorze na stałą dysocjacji (α):
α = [H+] : C
Dane podstawiamy do wzoru, by uzyskać stężenie jonów wodorowych.
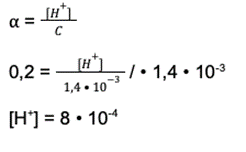
Krok 5: Wartość stężenia jonów wodorowych podstawiamy do wzoru na pH.
pH = -log[H+] = -log(8 • 10-4 ) = 3,1