1. <
2. <
3. <
4. >
5. =
6. =
7. >
8. >
9. <
10. >

Þ Dotyczy punktów 1 i 3:
Promień to odległość elektronów położonych najdalej od jądra.
Promienie kationów są zawsze najmniejsze. Promienie anionów są zawsze największe. Pośrednią długość wykazują promienie atomów macierzystych w stanie podstawowym.
W obrębie grupy im wyższa liczba atomowa, tym dłuższy promień, ponieważ rośnie liczba powłok, na których rozmieszczone są elektrony, a co za tym idzie- odległość najdalej położonego od jądra elektronu.
W obrębie okresu im wyższa liczba atomowa, tym krótszy promień, ponieważ wraz ze wzrostem ładunku jądra, rośnie siła przyciągania elektronów przez to jądro, co skraca promień.
Þ Dotyczy punktu 2:
Energia jonizacji to minimalna ilość energii, jaka jest potrzebna by oderwać elektron od obojętnego elektrycznie atomu pierwiastka chemicznego.
Wartość tej energii dla litowców maleje w obrębie grupy wraz ze wzrostem liczby atomowej.
Þ Dotyczy punktu 4:
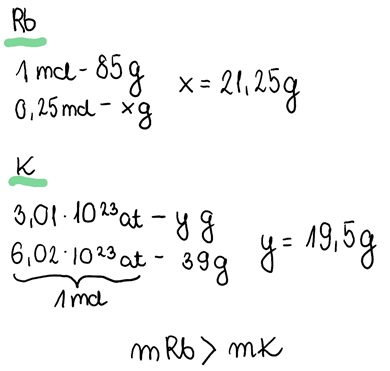
Þ Dotyczy punktu 5:
W skład rdzenia atomowego wchodzą protony oraz elektrony niewalencyjne danego pierwiastka.
Dla cezu:
Liczba protonów = 55 (ładunek dodatni)
Liczba elektronów niewalencyjnych = 54 (ładunek ujemny)
Ładunek rdzenia = 55-54 = +1
Dla sodu:
Liczba protonów = 11 (ładunek dodatni)
Liczba elektronów niewalencyjnych = 10 (ładunek ujemny)
Ładunek rdzenia = 55-54 = +1
Þ Dotyczy punktu 6:
Konfiguracja elektronów walencyjnych:
a) Dla sodu: 3s1
b) Dla potasu: 4s1
· n- główna liczba kwantowa- odpowiada numerowi powłoki, na której znajduje się elektron- dla sodu=3, dla potasu= 4;
· l- poboczna liczba kwantowa- dla podpowłoki s jest zawsze równa 0, dla p- 1, dla d-2 i dla f-3;
· m- magnetyczna liczba kwantowa- zawsze przybiera wartości z przedziału od -l do +l- w tym przypadku wynosi 0 dla obu pierwiastków.
Þ Dotyczy punktu 7:
Elektroujemność to miara zdolności atomu do przyciągania elektronów w czasie tworzenia wiązania chemicznego. Wartość ta w obrębie grupy maleje wraz ze wzrostem liczby atomowej.
Þ Dotyczy punktu 8:
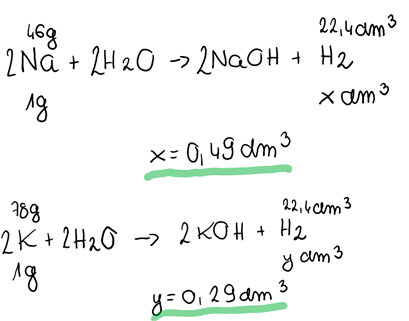
Þ Dotyczy punktu 9:
Mocniejszym kwasem jest kwas azotowy (III), którego reszta kwasowa tworzy NaNO2 niżeli kwas mrówkowy, którego reszta kwasowa tworzy sól HCOONa.
W związku z tym, NaNO2 będzie mieć niższe pH niżeli HCOONa o tym samym stężeniu.
Na porównanie mocy kwasów pozwala porównanie wartości ich stałych dysocjacji, dostępnych w tablicach maturalnych.
Þ Dotyczy punktu 10:
Im większa aktywność pierwiastka grupy I, tym szybciej reaguje on z wodą.
Aktywność chemiczna pierwiastków grupy I rośnie wraz ze wzrostem liczby atomowej.