HClO2
![]() H+ + ClO2-
H+ + ClO2-
K = 1,1 ∙ 10-2
C/K =
![]() = 9,1 < 400
= 9,1 < 400
K =
![]()
(1 - α) ∙ K = α2∙ C | ÷ K
1 – α =
![]() | + α – 1
| + α – 1
0 =
![]() + α – 1 | ∙ K
+ α – 1 | ∙ K
C ∙ α2 + K ∙ α + K = 0
α1 = 0,28
α2 = - 0,39 | nie należy do dziedziny [0,1].
Liczymy stężenie jonów H+:
0,28 ∙ 0,1
![]() = 0,028
= 0,028
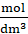 = [H+]
= [H+]
pH = – log([H+]) = – log(0,028) = 1,55

Dzieląc stężenie przez stałą dysocjacji, dowiadujemy się, że nie możemy użyć wzoru uproszczonego Ostwalda. Przekształcając wzór, otrzymujemy równanie kwadratowe z niewiadomą α, która jest stopniem dysocjacji. Rozwiązując je, dostajemy dwa rozwiązania, z których musimy wybrać te mieszczące się w przedziale 0 – 1. Mnożymy stopień dysocjacji przez stężenie i otrzymujemy stężenie jonów H+ odpowiadających wartości pH. Wstawiamy to stężenie do wzoru na ujemny logarytm, obliczamy tę wielkość i otrzymujemy odpowiedź.