CH3COOH
![]() CH3COO- + H+
CH3COO- + H+
CH3COOK
![]() CH3COO- + K+
CH3COO- + K+
CH3COO- + H2O ↔ CH3COOH + OH-
CH3COOK = 98
![]()
Obliczamy wprowadzoną liczbę moli CH3COOK:
765,625 mg ÷ 98
![]() = 0,0078125 mol
= 0,0078125 mol
Liczymy stężenie molowe CH3COOK:
CCH3COOK =
![]() = 0,015625
= 0,015625
![]()
Obliczamy wprowadzoną liczbę moli CH3COOH:
15 cm3∙ 0,45
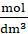 = 0,00675 mol
= 0,00675 mol
Liczymy stężenie molowe CH3COOH:
CCH3COOH =
![]() = 0,0135
= 0,0135
![]()
Podstawiamy wartości do końcowego wzoru na pH:
pH = – log(Ka) + log
![]() = – log(1,8 ∙ 10-5) + log
= – log(1,8 ∙ 10-5) + log
![]() = 4,81
= 4,81

Aby obliczyć pH roztworu buforowego, potrzebujemy wartości kwasowej stałej dysocjacji i stężeń zasadowego i kwasowego składnika buforu. Obliczamy najpierw, ile moli jednego i drugiego zostaje wprowadzonych do roztworu, a następnie liczymy ich stężenie molowe, wiedząc, że cały roztwór ma objętość 500 cm3. Na koniec podstawiamy wszystkie wartości do wzoru na pH roztworów buforowych i otrzymujemy wynik.