![]()
2 ∙ 0,0072
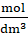 = 0,0144
= 0,0144
![]()
![]()
![]()
![]()
![]()

Wskaźnik pH jest ujemnym logarytmem ze stężenia jonów H+ w roztworze. Zapisujemy równanie reakcji. Kwas siarkowy(VI) jest mocnym elektrolitem, więc dysocjuje całkowicie. Patrząc na prawą i lewą stronę równania, widzimy, że na każdą cząsteczkę kwasu przypadają dwa jony wodoru, więc stężenie jonów H+ będzie dwa razy większe od stężenia kwasu. Wstawiamy wartość stężenia jonów pod ujemny logarytm o podstawie 10 i otrzymujemy pH.