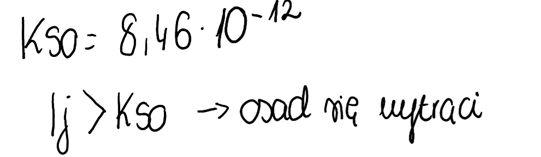1. Zapisujemy równanie zachodzącej reakcji:
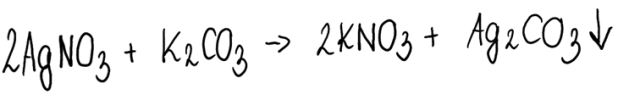
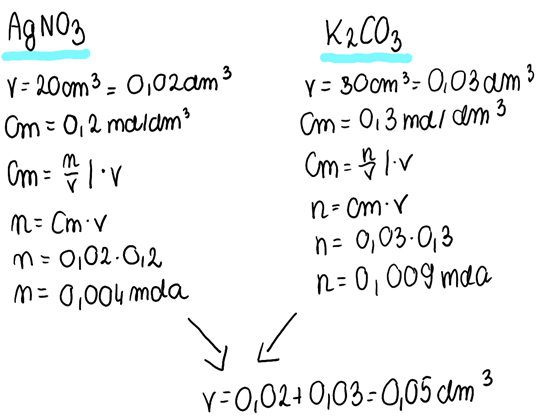
2. Mając informacje o substratach reakcji, z przekształconego wzoru na stężenie molowe obliczamy liczby moli substratów, a także sumaryczną objętość roztworu po zmieszaniu substratów:
3. Korzystając z informacji obliczonych w punkcie 2., obliczamy stężenie jonów tworzących osad:
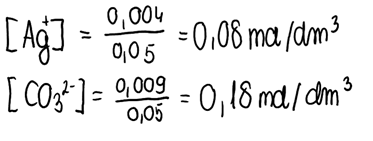
4. Zapisujemy równanie rozkładu osadu na jony, a na jego podstawie- wyrażenie na iloczyn jonowy tego związku.
Iloczyn jonowy to iloczyn stężeń jonów, gdzie w sytuacji, gdy jakikolwiek jon w równaniu ma współczynnik stechiometryczny różny od 1, to do takiej potęgi podnosimy owe stężenie:
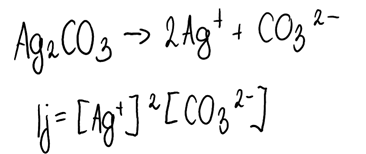
5. Obliczamy iloczyn jonowy:
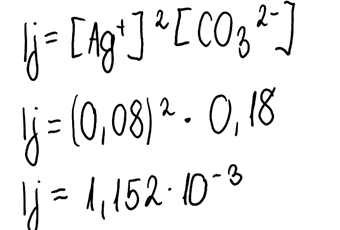
6. Porównujemy iloczyn jonów z iloczynem rozpuszczalności tej soli, której wartość można zaczerpnąć z tablic maturalnych tudzież Internetu czy podręcznika. Następnie ustalamy czy osad się wytrąci, wykorzystując następujące zależności:
· Kso < Ij à osad się wytrąca- roztwór przesycony;
· Kso > Ij à osad się nie wytrąca- roztwór nienasycony;
· Kso = Ij à roztwór nasycony.