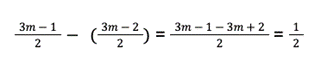Założenie: m = 1
Spalanie kwasu alkenowego: (3m – 2) : 2 = (3 ∙ 1 – 2) : 2 = 1 : 2 = 0,5
Spalanie kwasu alkenowego: (3m – 1) : 2 = (3 ∙ 1 – 1) : 2 = 2 : 2 = 1
Odpowiedź: Do całkowitego spalenia 1 mola monokarboksylowego kwasu alkanowego zużywa się o 0,5 mola mniej tlenu niż do całkowitego spalenia 1 mola monokarboksylowego kwasu alkenowego o tej samej liczbie atomów węgla w cząsteczce.

Zakładamy, że w obu cząsteczkach kwasów liczba atomów węgla m równa się 1. Na tej podstawie obliczamy liczbę atomów tlenu niezbędną do reakcji spalań.
Spalanie kwasu alkenowego: (3m – 2) : 2 = (3 ∙ 1 – 2) : 2 = 1 : 2 = 0,5
Spalanie kwasu alkenowego: (3m – 1) : 2 = (3 ∙ 1 – 1) : 2 = 2 : 2 = 1
Porównaj wyniki. W spalaniu kwasu alkenowego niezbędne jest o 0,5 mola więcej tlenu.
Można też na liczbach ogólnych odjąć współczynnik przed tlenem dla spalania kwasu alkenowego od współczynnika przed tlenem dla spalania kwasu alkanowego: