Oblicz jakie objętości azotu i wodoru należy zmieszać, aby otrzymać 200 g amoniaku.
395 dm3 wodoru, 132 dm3 azotu

![]()
m NH3 – 17 g/mol
Objętość 1 mola gazu w warunkach normalnych to 22,4 dm3
Objętość wodoru, z równania reakcji wiadomo, że 2 mole amoniaku – 34 g – powstają z 3 moli wodoru:
34 g amoniaku – 3∙22,4 dm3 wodoru
200 g – x dm3
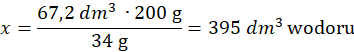
Objętość azotu, z równania reakcji wiadomo, że 2 mole amoniaku – 34 g – powstają z 1 mola azotu:
34 g amoniaku – 22,4 dm3
200 g – y dm3
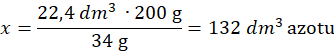

Ćwiczenie 4.42.
75Ćwiczenie 4.51.
77Ćwiczenie **4.60.
78Ćwiczenie *4.74.
79Ćwiczenie *4.75.
79Ćwiczenie *4.94.
83Ćwiczenie *4.99.
83Ćwiczenie 4.143.
93Ćwiczenie 4.146.
94Ćwiczenie 4.147.
94Ćwiczenie 4.148.
94Ćwiczenie 4.149.
94Ćwiczenie 4.150.
94Ćwiczenie 4.151.
94Ćwiczenie *4.160.
96Ćwiczenie 4.161.
96Ćwiczenie *4.166.
97Ćwiczenie 4.167.
100Ćwiczenie 4.168.
100Ćwiczenie 4.180.
102Ćwiczenie *4.184.
102Ćwiczenie 4.188.
103Ćwiczenie 4.189.
103Ćwiczenie 4.190.
103Ćwiczenie 4.191.
103Ćwiczenie 4.193.
103Ćwiczenie 4.194.
103Ćwiczenie 4.197.
104Ćwiczenie *4.198.
104Ćwiczenie 4.202.
108Ćwiczenie 4.218.
110Ćwiczenie 4.219.
110
