Oblicz ilość otrzymanego wodoru z podanych reakcji.
5,6 dm3

Układamy 2 reakcje – 1. z produktem Fe2O3, 2. z produktem Fe3O4.
![]()
![]()
Obliczamy ilość użytego w reakcjach żelaza i powstałych produktów używając proporcji.
x – masa Fe w reakcji 1.
y – masa Fe2O3
Reakcja 1.
x g Fe – y g Fe2O3
112 g Fe – 160 g Fe2O3
![]()
![]()
Reakcja 2.
(10 – x) g Fe – (14 – y) g Fe3O4
168 g Fe – 232 g Fe2O3
![]()
Stwórz układ równań:
![]()
![]()
![]()
![]()
![]()
Objętość powstałego wodoru z reakcji 1 – z równania wynika, że z 112 g Fe powstają 3 mole wodoru – 1 mol w warunkach normalnych ma objętość 22,4 dm3
112 g Fe - 3∙22,4 dm3
4 g Fe – a
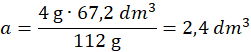
Objętość wodoru z reakcji 2 – z równania wynika, że z 168 g Fe powstają 4 mole wodoru – 1 mol w warunkach normalnych ma objętość 22,4 dm3
168 g Fe - 4∙22,4 dm3
10-4 g Fe – b
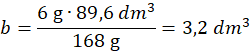
Całkowita objętość wodoru: 5,6 dm3

Ćwiczenie 4.42.
75Ćwiczenie 4.51.
77Ćwiczenie **4.60.
78Ćwiczenie *4.74.
79Ćwiczenie *4.75.
79Ćwiczenie *4.94.
83Ćwiczenie *4.99.
83Ćwiczenie 4.143.
93Ćwiczenie 4.146.
94Ćwiczenie 4.147.
94Ćwiczenie 4.148.
94Ćwiczenie 4.149.
94Ćwiczenie 4.150.
94Ćwiczenie 4.151.
94Ćwiczenie *4.160.
96Ćwiczenie 4.161.
96Ćwiczenie *4.166.
97Ćwiczenie 4.167.
100Ćwiczenie 4.168.
100Ćwiczenie 4.180.
102Ćwiczenie *4.184.
102Ćwiczenie 4.188.
103Ćwiczenie 4.189.
103Ćwiczenie 4.190.
103Ćwiczenie 4.191.
103Ćwiczenie 4.193.
103Ćwiczenie 4.194.
103Ćwiczenie 4.197.
104Ćwiczenie *4.198.
104Ćwiczenie 4.202.
108Ćwiczenie 4.218.
110Ćwiczenie 4.219.
110
