Oblicz masę metalu użytego w opisanej reakcji.
48 u

x – masa E
![]()
Ilość moli otrzymanego wodoru:
Dane:
V – 195 cm3 = 0,195 dm3
T – 285 K
p –1013 hPa
n – ?
Dane podstawiamy do przekształconego równania Clapeyrona:
![]()
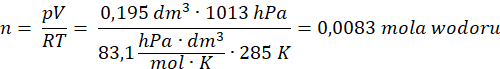
Masa 0,0083 mola wodoru:
1 mol wodoru – 2 g
0,0083 mol – y g
![]()
Na podstawie danych i współczynników z reakcji zapisujemy proporcje:
n/a ∙ x – wypiera 2n/a ∙2 g wodoru
0,2 g – 0,0166
![]()
![]()
![]()
![]()

Ćwiczenie 4.42.
75Ćwiczenie 4.51.
77Ćwiczenie **4.60.
78Ćwiczenie *4.74.
79Ćwiczenie *4.75.
79Ćwiczenie *4.94.
83Ćwiczenie *4.99.
83Ćwiczenie 4.143.
93Ćwiczenie 4.146.
94Ćwiczenie 4.147.
94Ćwiczenie 4.148.
94Ćwiczenie 4.149.
94Ćwiczenie 4.150.
94Ćwiczenie 4.151.
94Ćwiczenie *4.160.
96Ćwiczenie 4.161.
96Ćwiczenie *4.166.
97Ćwiczenie 4.167.
100Ćwiczenie 4.168.
100Ćwiczenie 4.180.
102Ćwiczenie *4.184.
102Ćwiczenie 4.188.
103Ćwiczenie 4.189.
103Ćwiczenie 4.190.
103Ćwiczenie 4.191.
103Ćwiczenie 4.193.
103Ćwiczenie 4.194.
103Ćwiczenie 4.197.
104Ćwiczenie *4.198.
104Ćwiczenie 4.202.
108Ćwiczenie 4.218.
110Ćwiczenie 4.219.
110
