Oblicz procent objętościowy NO w mieszaninie równowagowej.
Ok. 2,4%

Równanie równowagi tego procesu:
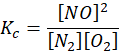
Z dwóch objętości substratów powstają dwie objętości produktów, więc całkowita objętość mieszaniny się nie zmienia.
Powietrze to mieszanina 20% tlenu i 80% azotu, więc przyjmij, że początkowo był 1 mol tlenu i 4 mole azotu.
| Początek | Reakcja | Równowaga | |
| N2 | 4 | - 0,5x | (4-0,5x) |
| O2 | 1 | -0,5x | (1-0,5x) |
| NO | - | + x | x |
Podstawiamy stężenia ze stanu równowagi do równania:
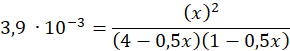
![]()
![]()
![]()
![]()
Otrymujemy równanie kwadratowe:
![]()
Obliczamy deltę, a następnie pierwiastek z delty:
![]()
![]()
![]()
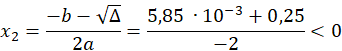
Uzupełniamy tabele wuzywając wyliczonego x:
| Równowaga |
| (4-0,5x) = 3,94 |
| (1-0,5x) = 0,94 |
| X = 0,12 |
| Suma: 5 moli |
5 moli – 100%
0,12 – y
![]()

Ćwiczenie 4.42.
75Ćwiczenie 4.51.
77Ćwiczenie **4.60.
78Ćwiczenie *4.74.
79Ćwiczenie *4.75.
79Ćwiczenie *4.94.
83Ćwiczenie *4.99.
83Ćwiczenie 4.143.
93Ćwiczenie 4.146.
94Ćwiczenie 4.147.
94Ćwiczenie 4.148.
94Ćwiczenie 4.149.
94Ćwiczenie 4.150.
94Ćwiczenie 4.151.
94Ćwiczenie *4.160.
96Ćwiczenie 4.161.
96Ćwiczenie *4.166.
97Ćwiczenie 4.167.
100Ćwiczenie 4.168.
100Ćwiczenie 4.180.
102Ćwiczenie *4.184.
102Ćwiczenie 4.188.
103Ćwiczenie 4.189.
103Ćwiczenie 4.190.
103Ćwiczenie 4.191.
103Ćwiczenie 4.193.
103Ćwiczenie 4.194.
103Ćwiczenie 4.197.
104Ćwiczenie *4.198.
104Ćwiczenie 4.202.
108Ćwiczenie 4.218.
110Ćwiczenie 4.219.
110
