Zidentyfikuj metal użyty w opisanej reakcji.
Cyrkon

Najpierw określ, ile moli HCl wzięło udział w reakcji.
1 mol HCl daje z 0,5 mola H2 – 11,2 dm3 = 11200 cm3 w warunkach normalnych:
1 mol – 11200 cm3
x moli – 49,2 cm3
![]()
Ilość chloru w uzytej próbce HCl:
1 mol HCl – zawiera 35,5 g Cl
0,0044 mola – y
![]()
Chlor połączył się ze 100 mg metalu – 0,1 g – powstało 0,256 g chlorku metalu.
Ilość chloru w 1 molu chlorku:
0,256 g – 0,156 g Cl
233 g – z
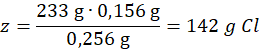
![]()
W chlorku znajdują się 4 atomy chloru.
M metalu:
![]()
91 g to masa molowa cyrkonu.

Ćwiczenie 4.42.
75Ćwiczenie 4.51.
77Ćwiczenie **4.60.
78Ćwiczenie *4.74.
79Ćwiczenie *4.75.
79Ćwiczenie *4.94.
83Ćwiczenie *4.99.
83Ćwiczenie 4.143.
93Ćwiczenie 4.146.
94Ćwiczenie 4.147.
94Ćwiczenie 4.148.
94Ćwiczenie 4.149.
94Ćwiczenie 4.150.
94Ćwiczenie 4.151.
94Ćwiczenie *4.160.
96Ćwiczenie 4.161.
96Ćwiczenie *4.166.
97Ćwiczenie 4.167.
100Ćwiczenie 4.168.
100Ćwiczenie 4.180.
102Ćwiczenie *4.184.
102Ćwiczenie 4.188.
103Ćwiczenie 4.189.
103Ćwiczenie 4.190.
103Ćwiczenie 4.191.
103Ćwiczenie 4.193.
103Ćwiczenie 4.194.
103Ćwiczenie 4.197.
104Ćwiczenie *4.198.
104Ćwiczenie 4.202.
108Ćwiczenie 4.218.
110Ćwiczenie 4.219.
110
