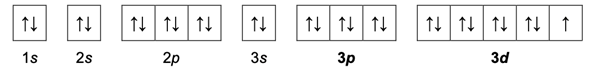

W przypadku miedzi ma miejsce promocja elektronowa- przejście elektronu z orbitalu o niższej energii na orbital o wyższej energii w tym samym atomie, zachodzące podczas tworzenia wiązań chemicznych.
Zjawisko to polega na tym, że atom „przestawia” elektrony tak, aby zwiększyć liczbę niesparowanych elektronów, co umożliwia mu tworzenie większej liczby wiązań kowalencyjnych.
Przy tworzeniu jonów zmienia się konfiguracja podpowłokowa atomu w zależności od tego, czy powstaje kation, czy anion.
Gdy atom tworzy kation, oddaje elektrony. Elektrony są zawsze usuwane z powłoki o najwyższym numerze n, czyli z najbardziej zewnętrznej powłoki. W przypadku metali przejściowych najpierw oddawane są elektrony z podpowłokins, a dopiero potem z podpowłoki (n−1)d, mimo że w zapisie konfiguracyjnym orbital ns pojawia się przed orbitalami d.
W przypadku anionów atom przyjmuje elektrony. Dodatkowe elektrony są dopisywane do wolnych miejsc w zewnętrznej podpowłoce, najczęściej do podpowłoki p.
Tworzenie jonów prowadzi zwykle do uzyskania trwałej konfiguracji elektronowej zbliżonej do konfiguracji gazu szlachetnego.