C2H4 + 3O2![]()
Objętość reaktora to 1 dm3, więc liczby moli można przyjąć za stężenia.
| C2H4 | 3O2 | 2CO2 | 2H2O | |
| Stężenie początkowe [mol/dm3] | X | 3X | 0 | 0 |
| Zmiana stężenia | -y | -3y | +2y | +2y |
| Stężenie równowagowe [mol/dm3] | 3 | 3 |
![]()
![]()
![]()
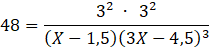
![]()
![]()

Na początku zauważ, że objętość reaktora to 1 dm3, więc liczby moli można uznawać jako stężenia. Narysuj tabelę, w której zapiszesz zależności pomiędzy stężeniem początkowym, zmianą stężenia, a stężeniem równowagowym. Wiadomo, że tlenu wprowadzono 3 razy więcej, dlatego stężenie początkowe etenu oznaczono X, a tlenu 3X:
| C2H4 | 3O2 | 2CO2 | 2H2O | |
| Stężenie początkowe | X | 3X | 0 | 0 |
| Zmiana stężenia | -y | -3y | +2y | +2y |
| Stężenie równowagowe | 3 | 3 |
Następnie oblicz zmianę stężenia, czyli y, co pozwoli określić stężenia równowagowe:
![]()
![]()
![]()
Korzystając z wyrażenia na stałą równowagi danej reakcji:
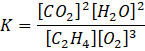
Podstaw dane:
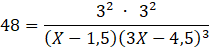
Wyznacz X i 3X:
![]()
![]()
