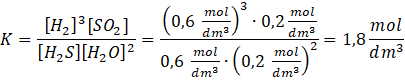2H2O + H2S ![]()
![]()
![]()
Przereagowało 25% H2S, czyli zostało 75%:
![]()
| 2 H2O | H2S | 3 H2 | SO2 | |
| Cpoczątkowe [mol/dm3] | 0,6 | 0,8 | 0 | 0 |
| ΔC | -2x | -x | +3x | +x |
| Crównowagowe [mol/dm3] | 0,6-2x | 0,6 | 3x | x |
![]()
![]()
![]()
![]()
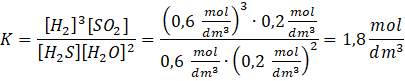

Na początku zapisz reakcję:
2H2O + H2S ![]()
Oblicz stężenia z podanych liczby moli i objętości:
![]()
![]()
Przereagowało 25% H2S, czyli zostało 75%:
![]()
Sporządź tabelę z zależnościami:
| 2 H2O | H2S | 3 H2 | SO2 | |
| Cpoczątkowe [mol/dm3] | 0,6 | 0,8 | 0 | 0 |
| ΔC | -2x | -x | +3x | +x |
| Crównowagowe [mol/dm3] | 0,6-2x | 0,6 | 3x | x |
Oblicz x:
![]()
![]()
![]()
![]()
Zapisz wzór na stężeniową stałą równowagi i podstaw dane: