Kwas B CnH2nO2 — 69,9% C, 4,9% H i 26,2% O
mO = 16 g/mol → mO2 = 32 g/mol
1. Węgiel
mC = 12 g/mol
32 g — 26,2%
x — 68,9%
x = 68,9 ∙ 32 : 26,2 = 84 [g] → 84 g : 12 g = 7 (liczba atomów węgla)
2. Wodór
mH = 1 g/mol
32 g — 26,2%
x — 4,9%
x = 4,9 ∙ 32 : 26,2 = 6 [g] → 6 g : 1 g = 6 (liczba atomów wodoru)
Wzór sumaryczny kwasu B: C7H6O2
150 g – m C7H6O2 = 150 g – 122 g = 28 g → —CH2CH3
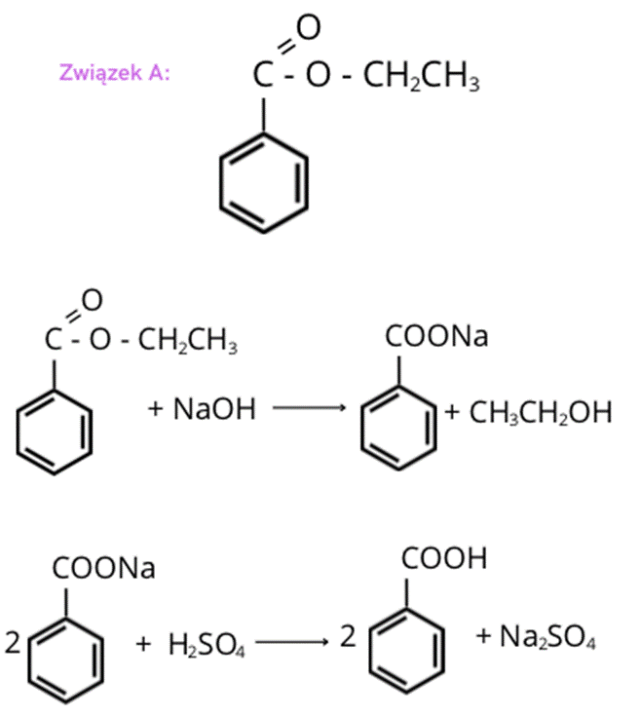

Przedstawiony ciąg reakcji to najpierw hydroliza zasadowa estru, a następnie reakcja soli kwasu karboksylowego z kwasem siarkowym(VI). W pierwszym kroku musimy znaleźć wzór kwasu karboksylowego, który tworzył związek A (ester).
Liczymy to na podstawie proporcji wiedząc, że dwa atomy tlenu w kwasie stanowią 26,2% związku.
Kwas B CnH2nO2 — 69,9% C, 4,9% H i 26,2% O
mO = 16 g/mol → mO2 = 32 g/mol
1. Węgiel
mC = 12 g/mol
32 g — 26,2%
x — 68,9%
x = 68,9 ∙ 32 : 26,2 = 84 [g] → 84 g : 12 g = 7 (liczba atomów węgla)
2. Wodór
mH = 1 g/mol
32 g — 26,2%
x — 4,9%
x = 4,9 ∙ 32 : 26,2 = 6 [g] → 6 g : 1 g = 6 (liczba atomów wodoru)
Wzór sumaryczny kwasu B: C7H6O2
Od masy związku A należy odjąć masę kwasu karboksylowego. Masy poszczególnych atomów znajdziesz w tabeli pierwiastków chemicznych.
mC7H6O2 = 7 ∙ 12 + 6 ∙ 1 + 2 ∙ 16 = 122 [g/mol]
150 g – m C7H6O2 = 150 g – 122 g = 28 g
Część pochodząca od alkoholu w estrze ma zatem 28 g. Wartość ta pasuje do fragmentu —CH2CH3. Ester A to zatem benzoesan etylu.
W reakcji hydrolizy kwasowej z estru powstaje odtworzony alkohol (tu: etanol) i sól kwasu karboksylowego (tu: benzoesan sodu). Atom sodu zostaje wyparty przez atom wodoru podczas reakcji kwasu siarkowego(VI) z benzoesanem sodu, ponieważ kwas siarkowy(VI) to kwas mocniejszy od kwasu benzoesowego. W efekcie powstaje sól kwasu siarkowego(VI) i kwas benzoesowy.