CH3CH2CH2COOH + CH3CH2OH ⇆H2SO4⇆ CH3CH2CH2COOCH2CH3 + H2O
| N0 | +/- | N⇆ | |
| CH3CH2CH2COOH | 1 | -0,85 | 0,15 |
| CH3CH2OH | x | -0,85 | x – 0,85 |
| CH3CH2CH2COOCH2CH3 | 0 | 0,85 | 0,85 |
| H2O | 0 | 0,85 | 0,85 |

Odpowiedź: Do tej reakcji wymagane jest 8 moli etanolu.

Krok 1: Zapisz równanie reakcji. Estryfikacja zachodzi według schematu:
R1COOH + R2OH → R1COOR2 + H2O, gdzie -R1 i -R2 oznaczają odpowiednie reszty węglowodorowe.
CH3CH2CH2COOH + CH3CH2OH ⇆H2SO4⇆ CH3CH2CH2COOCH2CH3 + H2O
Krok 2: Wydajność reakcji ma wynosić 85%. Zatem z 1 mola kwasu przereagować musi:
85% ∙ 1 mol : 100% = 0,85 mol
Krok 3: Sporządź tabelę. W kolumnach umieszczamy:
— początkową liczbę moli (1 dla kwasu, x dla etanolu, 0 dla estru i wody),
— liczbę moli, która odeszła z układu lub do niego doszła (-0,85 dla kwasu, – 0,85 dla alkoholu, + 0,85 dla produktów, ponieważ stechiometrycznie reakcja zachodzi w proporcjach molowych 1 : 1 : 1 : 1).
— końcową liczbę moli: 0,85 dla estru i alkoholu, 0,15 dla kwasu i x – 0,85 dla alkoholu.
Krok 4: Wzór na stałą równowagi reakcji:
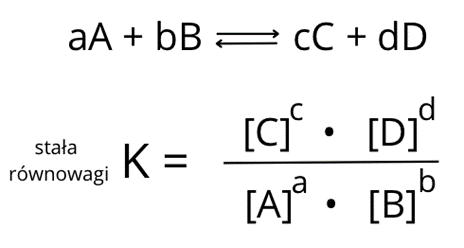
Dane podstawiamy do wzoru:
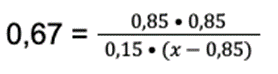
Krok 5: Rozwiązujemy równanie:

x był początkową ilością moli alkoholu, więc na tym kończy się rozwiązanie zadania.