mtoluenu = 92 g/mol
mkwasu benzoesowego = 122 g/mol
92 g toluenu — 122 g kwasu benzoesowego
18,4 g toluenu — x
x = 18,4 ∙ 92 : 122 = 24,4 [g kwasu benzoesowego]
Wydajność reakcji = (85 ∙ 90) : 100 = 76,5 [%]
24,4 g — 100%
y — 76,6%
y = 24,4 ∙ 76,6 : 100 = 18,7 [g]
Odpowiedź: W tej reakcji otrzymamy 18,7 g związku C (kwasu benzoesowego).

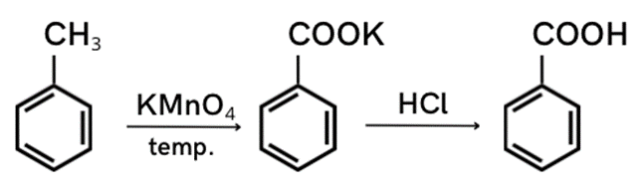
Krok 1: Uzupełnij schemat reakcji.
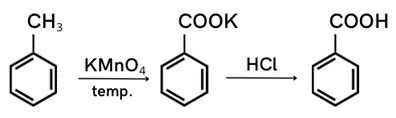
Benzoesan potasu w reakcji z mocniejszym kwasem chlorowodorowym daje kwas benzoesowy i sól jako produkt uboczny (chlorek potasu).
Krok 2: Oblicz masy molowe toluenu i kwasu benzoesowego. Masy poszczególnych atomów znajdziesz w tabeli pierwiastków chemicznych.
mtoluenu = 7 ∙ 12 + 8 ∙ 1 = 92 [g/mol]
mkwasu benzoesowego = 12 ∙ 7 + 1 ∙ 6 + 16 ∙ 2 = 122 [g/mol]
Krok 3: Spójrz na wartości stechiometryczne. 1 mol toluenu daje 1 mol kwasu. Oblicz ilość kwasu, którą otrzymujemy z 18,4 g toluenu.
92 g toluenu — 122 g kwasu benzoesowego
18,4 g toluenu — x
x = 18,4 ∙ 92 : 122 = 24,4 [g kwasu benzoesowego]
Krok 4: Uwzględnij wydajność reakcji. Sumaryczną wydajność procesów liczymy według wzoru:
całkowita wydajność reakcji 2 i 3 = (wydajność reakcji 2 ∙ wydajność reakcji 3) : 100
Dane podstawiamy do wzoru:
Wydajność reakcji = (85 ∙ 90) : 100 = 76,5 [%]
Krok 5: Obliczona masa kwasu (24,4 g) powstaje przy wydajności procesu 100%. Policz ilość produktu przy wydajności 76,5%.
24,4 g — 100%
y — 76,6%
y = 24,4 ∙ 76,6 : 100 = 18,7 [g]