CH3COOH + C2H5OH ⇆H2SO4⇆ CH3COOC2H5 + H2O
mCH3COOH = 60 g/mol
mC2H5OH = 46 g/mol
0,8 g — 1 cm3
y — 115 cm3
y = 115 ∙ 0,8 : 1 = 92 [g] → 92 g : 46 g = 2 (liczba moli C2H5OH)
| N0 | +/- | N⇆ | |
| CH3COOH | 1 | - x | 1 – x |
| C2H5OH | 2 | - x | 2 – x |
| CH3COOC2H5 | 0 | + x | x |
| H2O | 0 | + x | x |

Odpowiedź: Po osiągnięciu stanu równowagi w układzie znajdowało się 9,3 g nieprzereagowanego kwasu, 53,13 g nieprzereagowanego alkoholu, 74,36 g estru i 15,21 g wody.

Krok 1: Zapisz równanie reakcji. Estryfikacja zachodzi według schematu:
R1COOH + R2OH → R1COOR2 + H2O, gdzie -R1 i -R2 oznaczają odpowiednie reszty węglowodorowe.
CH3COOH + CH3CH2OH ⇆H2SO4⇆ CH3COOCH2CH3 + H2O
Krok 2: Oblicz liczbę moli kwasu octowego w układzie na podstawie masy molowej. Masy poszczególnych atomów znajdziesz w tabeli pierwiastków chemicznych.
mCH3COOH = 12 + 3 ∙ 1 + 12 + 16 + 16 + 1 = 60 [g/mol] → w układzie jest 1 mol kwasu
Krok 3: Oblicz masę alkoholu w układzie na podstawie gęstości. Następnie na podstawie tej masy oblicz liczbę moli alkoholu w układzie (analogicznie jak dla kwasu octowego).
mC2H5OH = 12 ∙ 2 + 5 ∙ 1 + 16 + 1 = 46 [g/mol]
0,8 g — 1 cm3
y — 115 cm3
y = 115 ∙ 0,8 : 1 = 92 [g] → 92 g : 46 g = 2 (liczba moli C2H5OH)
Krok 4: Sporządź tabelę. W kolumnach umieszczamy:
— początkową liczbę moli (1 dla kwasu, 2 dla etanolu, 0 dla estru i wody),
— liczbę moli, która odeszła z układu lub do niego doszła (-x dla substratów, +x dla produktów, ponieważ stechiometrycznie reakcja zachodzi w proporcjach molowych 1 : 1 : 1 : 1).
— końcową liczbę moli: x dla estru i alkoholu, 1 – x dla kwasu i 2 – x dla alkoholu.
Krok 5: Wzór na stałą równowagi reakcji:
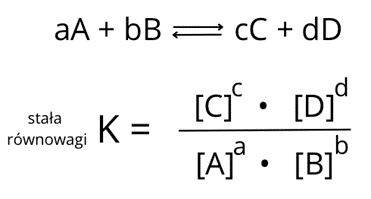
Dane podstawiamy do wzoru:
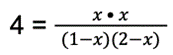
Krok 6: Rozwiązujemy równanie:
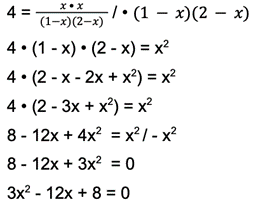
Krok 7: Liczymy deltę. Wzór na deltę to:
Δ = b2 – 4ac, gdzie:
a = 3, b = -12, c = 8
Dane podstawiamy do wzoru:
Δ = b2 – 4ac = (-12)2 – 4 ∙ 3 ∙ 8 = 144 – 96 = 48
Krok 8: Do wyliczenia wartości x niezbędny nam jest pierwiastek z delty, czyli pierwiastek z 48 = 6,93
Uzupełniamy wzory na dwie wartości x:
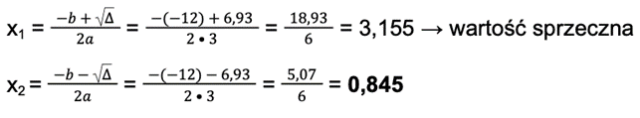
Pierwsza wartość (x1) jest sprzeczna, ponieważ, gdybyśmy podstawili ją do wartości w tabeli (np. dla kwasu), to końcowa liczba moli będzie ujemna, a jest to niemożliwe. Próba policzenia liczby moli kwasu z x1:
n = 1 – x = 1 – 3,155 = -2,155 < 0
Krok 9: Liczymy masę molową estru i wody. Masy poszczególnych atomów znajdziesz w tabeli pierwiastków chemicznych.
mCH3COOC2H5 = 12 + 3 ∙ 1 + 12 + 16 + 16 + 2 ∙ 12 + 5 ∙ 1 = 88 [g/mol]
mH2O = 2 ∙ 1 + 16 = 18 [g/mol]
Krok 10: Aby obliczyć liczbę gramów wszystkich substancji korzystamy ze wzoru:
masa pozostałego związku = N⇆ ∙ masa molowa związku, gdzie N⇆ to końcowa liczba moli.
Dane podstawiamy do wzoru:
masa CH3COOH = (1 – x) ∙ 60 = (1 – 0,845) ∙ 60 = 0,155 ∙ 60 = 9,3 [g]
masa C2H5OH = (2 – x) ∙ 46 = (2 – 0,845) ∙ 46 = 1,155 ∙ 46 = 53,13 [g]
masa CH3COOC2H5 = x ∙ 88 = 0,845 ∙ 88 = 74,36 [g]
masa H2O = x ∙ 18 = 0,845 ∙ 18 = 15,21 [g]