mKOH = 56 g/mol = 56000 mg/mol
LZ dla tristearynianu glicerolu:
mtristearynianu glicerolu = 890 g/mol
890 g tristearynianu glicerolu — 168000 mg wodorotlenku potasu
1 g tristearynianu glicerolu — x
x = 168000 ∙ 1 : 890 = 188,76 [mg wodorotlenku potasu] → LZ dla tristearynianu glicerolu = 188,76
LZ dla tripalmitynianu glicerolu:
mtripalmitynianu glicerolu = 806 g/mol
806 g tripalmitynianu glicerolu — 168000 mg wodorotlenku potasu
1 g tripalmitynianu glicerolu — y
y = 168000 ∙ 1 : 806 = 208,18 [mg wodorotlenku potasu] → LZ dla tripalmitynianu glicerolu = 208,44
Odpowiedź: Liczba zmydlania dla tristearynianu glicerolu wynosi 188,76, a dla tripalmitynianu glicerolu 208,44.

Krok 1: Spójrz na równanie reakcji. Jeden mol glicerydu wymaga trzech moli wodorotlenku potasu:
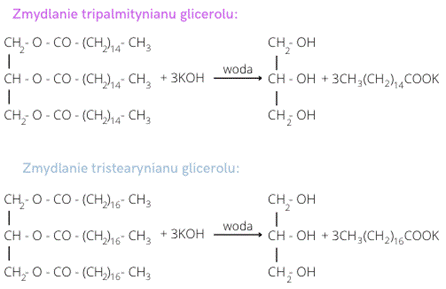
Krok 2: Oblicz masę jednego mola wodorotlenku potasu w mg. Masę poszczególnych atomów znajdziesz w tabeli pierwiastków chemicznych. Pamiętaj, że 1 g to 1000 mg.
mKOH = 39 + 16 + 1 = 56 [g/mol] = 56000 mg/mol
Na tej podstawie wiemy, że w reakcji bierze udział 3 ∙ 56000 mg KOH = 168000 mg KOH
Krok 3: Oblicz masę jednego mola tristearynianu glicerolu. Jego wzór sumaryczny to C57H110O6.
mtristearynianu glicerolu = 57 ∙ 12 + 110 ∙ 1 + 6 ∙ 16 = 890 [g/mol]
Krok 4: Porównaj wartości stechiometryczne z ilością glicerydu niezbędną do obliczenia LZ (1 g).
890 g tristearynianu glicerolu — 168000 mg wodorotlenku potasu
1 g tristearynianu glicerolu — x
x = 168000 ∙ 1 : 890 = 188,76 [mg wodorotlenku potasu] → LZ dla tristearynianu glicerolu = 188,76
Krok 5: Oblicz masę jednego mola tripalmitynianu glicerolu. Jego wzór sumaryczny to C51H98O6.
mtristearynianu glicerolu = 51 ∙ 12 + 98 ∙ 1 + 6 ∙ 16 = 806 [g/mol]
Krok 4: Porównaj wartości stechiometryczne z ilością glicerydu niezbędną do obliczenia LZ (1 g).
806 g tripalmitynianu glicerolu — 168000 mg wodorotlenku potasu
1 g tripalmitynianu glicerolu — y
y = 168000 ∙ 1 : 806 = 208,44 [mg wodorotlenku potasu] → LZ dla tripalmitynianu glicerolu = 208,44