W tym samym stężeniu i temperaturze, kwas chlorowodorowy ma większy stopień dysocjacji niż kwas octowy.

Stopień dysocjacji (α) wyrażamy równaniem:
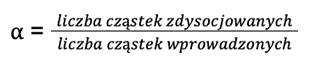
Kwasy dzielimy na słabe i mocne. Kwasy mocne (takie jak kwas chlorowodorowy) dysocjują w roztworach wodnych znacznie lepiej niż kwasy słabe (takie jak kwas octowy). Zatem w podanym równaniu wartość liczby cząstek zdysocjowanych jest większa dla HCl. Im większy licznik ułamka, tym wyższy wynik – zatem stopień dysocjacji (α) dla HCl jest większy niż dla CH3COOH.