5CH3—CH2—C(CH3)=C(CH3)—CH3 + 2H2O + 2MnO4- + 6H+ → 5CH3—CH2—COH(CH3)—COH(CH3)—CH3 + 2Mn2+
CH3—CH2—C(CH3)=C(CH3)—CH3 + 2H2O → CH3—CH2—COH(CH3)—COH(CH3)—CH3 + 2e + 2H+ / ∙ 5
MnO4- + 5e + 8H+ →2Mn2+ + 4H2O / ∙ 2

Aby rozwiązać takie równanie musimy skorzystać z zasady redoks (utlenianie-redukcja).
Krok 1: Zwróć uwagę na stopnie utlenienia atomów pierwiastków. Ładunek związku wynosi 0, o ile nie są zaznaczone jony. Jeśli są – ładunek jest im równy. Tlen ma wartościowość -II, wodór I. Obliczamy wartościowość tych atomów, które uległy zmianie (mangan i węgiel).
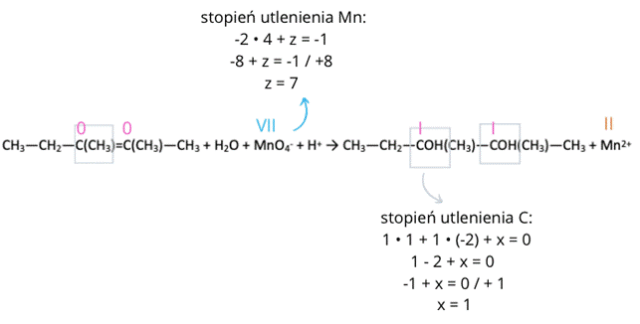
Krok 2: Zapisz związki, w których zmienia się stopień utlenienia. Dodaj odpowiednią ilość elektronów tak, by wyrównać tę zmianę. Pamiętaj, że elektrony mają wartości -1! Zwróć uwagę, że po lewej stronie równania są dwa atomy węgla, więc wartość musi być dwukrotnie większa, bo dwa atomy przechodzą z 0 na I stopień utlenienia.
CH3—CH2—C(CH3)=C(CH3)—CH3 → CH3—CH2—COH(CH3)—COH(CH3)—CH3 + 2e +
MnO4- + 5e → Mn2+
Krok 3: Wyrównaliśmy wartości zmiany stopnia utlenienia. Teraz zwróć uwagę na jony. Jony możemy wyrównać tym, co mamy w równaniu głównym (w tym przypadku kationy wodoru). Dodajemy je tak, by wartości po obu stronach równania były takie same.
CH3—CH2—C(CH3)=C(CH3)—CH3 → CH3—CH2—COH(CH3)—COH(CH3)—CH3 + 2e + 2H+
MnO4- + 5e + 8H+ → Mn2+
Krok 4: Uzgodnienie obu równań przy pomocy wody tak, by liczby atomów się zgadzały.
CH3—CH2—C(CH3)=C(CH3)—CH3 + 2H2O → CH3—CH2—COH(CH3)—COH(CH3)—CH3 + 2e + 2H+
MnO4- + 5e + 8H+ → Mn2+ + 4H2O
Krok 5: Równania mnożymy tak, by liczby dodanych elektronów były równe w jednym i w drugim równaniu. W pierwszym dodaliśmy dwa elektrony – w drugim pięć. Stąd pierwsze równanie mnożymy pięciokrotnie, a drugie dwukrotnie.
CH3—CH2—C(CH3)=C(CH3)—CH3 + 2H2O → CH3—CH2—COH(CH3)—COH(CH3)—CH3 + 2e + 2H+ / ∙ 5
MnO4- + 5e + 8H+ → Mn2+ + 4H2O / ∙ 2
Efekt:
5CH3—CH2—C(CH3)=C(CH3)—CH3 + 10H2O → 5CH3—CH2—COH(CH3)—COH(CH3)—CH3 + 10e + 10H+
2MnO4- + 10e + 16H+ → 2Mn2+ + 8H2O
Krok 6: Zapisujemy całość równania. Sumujemy lewe i prawe strony równań.
5CH3—CH2—C(CH3)=C(CH3)—CH3 + 10H2O + 2MnO4- + 10e + 16H+ → 5CH2OH—CH2OH + 10e + 10H+ + 2Mn2+ + 8H2O
Krok 7: Skracamy równanie do najmniejszych możliwych wartości. Usuwamy to, co powtarza się po obu stronach.
5CH3—CH2—C(CH3)=C(CH3)—CH3 + 10H2O + 2MnO4- + 10e + 16H+ → 5CH2OH—CH2OH + 10e + 10H+ + 2Mn2+ + 8H2O / – 10e, -10H+, -8H2O
5CH3—CH2—C(CH3)=C(CH3)—CH3 + 2H2O + 2MnO4- + 6H+ → 5CH3—CH2—COH(CH3)—COH(CH3)—CH3 + 2Mn2+