Magnez: K2 L8 M2
Bor: K2 L3
Fosfor: K2 L7
Wapń: K2 L8 M8 N2

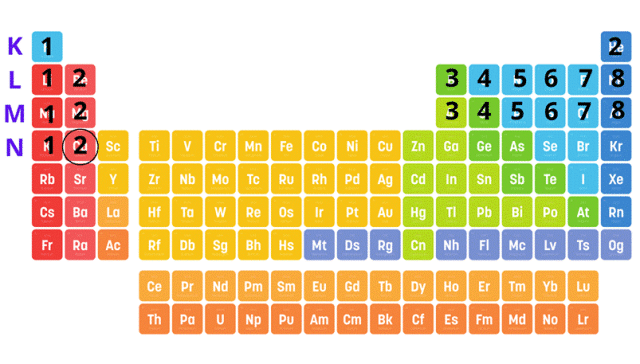
Spójrz do układu okresowego pierwiastków. W pierwszym kroku zlokalizuj każdy z pierwiastków. Ustal, w którym okresie leży pierwiastek. Numer okresu odpowiada ilości powłok elektronowych (okres 1 – tylko powłoka K, okres 2 – powłoki K i L, okres 3 – powłoki K, L i M, okres 4 – powłoki K, L, M i N). Magnez leży w trzecim okresie, więc ma trzy powłoki. Analogicznie bor i fosfor mają dwie powłoki, a wapń cztery. Spójrz na liczby atomowe – odpowiadają one ilości elektronów w atomie każdego z pierwiastków (magnez – 12, bor – 5, fosfor – 9, wapń – 20). Całkowita suma indeksów górnych wszystkich powłok musi odpowiadać liczbie atomowej pierwiastka.
Za przykład posłuży nam wapń.
Wapń leży w czwartym okresie – ma zatem cztery powłoki. Jego liczba atomowa to 20, więc atom wapnia ma 20 elektronów. Policz liczbę elektronów w każdej z powłok – najprościej zrobisz to, licząc pierwiastki w każdym z okresów, które poprzedzają wapń.