O2-:K2 L8
Konfiguracja pełna: 1s2 2s2 2p6
Konfiguracja skrócona: [Ne]
Li+:K2
Konfiguracja pełna: 1s2
Konfiguracja skrócona: [He]
Cl-:K2 L8 M8
Konfiguracja pełna: 1s2 2s2 2p6 3s2 3p6
Konfiguracja skrócona: [Ar]
Mg2+ K2 L8
Konfiguracja pełna: 1s2 2s2 2p6
Konfiguracja skrócona: [Ne]
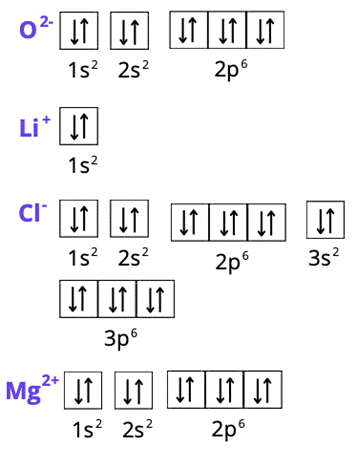

Spójrz do układu okresowego pierwiastków. W pierwszym kroku zlokalizuj każdy z pierwiastków. Ustal, w którym okresie leży pierwiastek. Numer okresu odpowiada ilości powłok elektronowych (okres 1 – tylko powłoka K, okres 2 – powłoki K i L, okres 3 – powłoki K, L i M, okres 4 – powłoki K, L, M i N). Tlen i magnez leżą w trzecim okresie, więc mają trzy powłoki, ale ich liczba elektronów zmieniła się, bo zostały one jonami. Lit ma jedną powłokę, a chlor – trzy. Spójrz na liczby atomowe – odpowiadają one ilości elektronów w atomie każdego z pierwiastków (do tego należy odpowiednio dodać wartość dla anionów i odjąć dla kationów – elektrony mają ładunek ujemny). Całkowita suma indeksów górnych wszystkich powłok musi odpowiadać liczbie elektronów atomu. Konfiguracja elektronowa ma na celu ukazanie elektronów na podpowłokach. Zapisujemy ją za pomocą literowych symboli podpowłok, których litery odpowiadają literom bloków w układzie okresowym. Podpowłokom towarzyszy główna liczba kwantowa (odpowiadająca numerowi okresu). Suma elektronów o tej samej głównej liczbie kwantowej odpowiada liczbie elektronów z odpowiedniej powłoki w zapisie powłokowym. Zapis skrócony konfiguracji tworzymy, używając symbolu gazu szlachetnego, który poprzedza w układzie okresowym pierwiastek chemiczny (w przypadku kationów), lub występuje po nim (dla anionów). Gazy szlachetne znajdują się w grupie 18. Dla magnezu i tlenu będzie to neon, dla jonu chlorkowego – argon. W zapisie skróconym opisujemy tylko ostatnią powłokę elektronową (ostatni okres). Zapis graficzny przedstawiamy za pomocą klatek Hunda. Jedna klatka odpowiada jednemu orbitalowi:
podpoziom typu s ma 1 orbital (1 kratka),
podpoziom typu p ma 3 orbitale (3 kratki),
podpoziom typu d ma 5 orbitali (5 kratek),
podpoziom typu s ma 7 orbitali (7 kratek).
Elektron przedstawiamy w formie strzałki w górę lub w dół – w zależności od orientacji spinu. Poprawny zapis wymaga stosowania się do zakazu Pauliego (w jednej klatce nie mogą współistnieć dwie strzałki o tym samym kierunku) i reguł Hunda. Reguły te mówią o tym, że:
1. Liczba niesparowanych (pojedynczych) elektronów na danym podpoziomie musi być jak największa.
2. Pary elektronów tworzymy dopiero, gdy pojedyncze elektrony wypełnią już wszystkie orbitale.
3. Niesparowane elektrony na dalej podpowłoce mają ten sam zwrot strzałek.