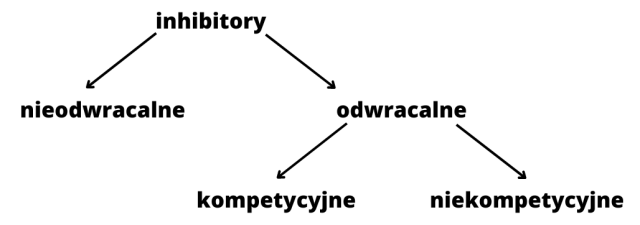

Inhibitor nieodwracalny kowalencyjnie wiąże się z cząsteczką enzymu, czego nie da się cofnąć np. trucizny, toksyny, antybiotyki.
Inhibitor odwracalny wiąże się z enzymem słabymi wiązaniami, co jest możliwe do odwrócenia.
Inhibitor kompetycyjny przypomina kształtem substrat, konkurując z nim o miejsce w centrum aktywnym.
Inhibitor niekompetycyjny jest innego kształtu niż substrat i przyłącza się do innej części enzymu niż centrum aktywne.