mC17H35COOH = 18 ∙ 12 g + 36 ∙ 1 g + 2∙ 16 g
mC17H35COOH = 284 g
%C17H35COOH = 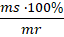
%C17H35COOH = ![]()
%C17H35COOH = 76,1%
mC17H33COOH = 18 ∙ 12 g + 34 ∙ 1 g + 2∙ 16 g
mC17H33COOH = 282 g
% C17H33COOH= ![]()
%C17H33COOH = ![]()
%C17H33COOH = 76,6%
Odpowiedź: Stężenie procentowe węgla jest większe w kwasie oleinowym, gdzie wynosi 76,6%. W kwasie stearynowym stężenie procentowe węgla jest równe 76,1%.

Na początku, korzystając z układu okresowego, oblicz masy cząsteczkowe obu kwasów. Przykładowe obliczenia dla kwasu stearynowego.
mC17H35COOH = 18 ∙ 12 g + 36 ∙ 1 g + 2∙ 16 g
mC17H35COOH = 284 g
Następnie, korzystając ze wzoru na stężenie procentowe, oblicz zawartość węgla w każdym z nich. Przykładowe obliczenia dla kwasu stearynowego.
%C17H35COOH = ![]()
%C17H35COOH = ![]()
%C17H35COOH = 76,1%
Przyjmij, że we wzorze na stężenie procentowe ,,ms” oznacza masę węgla a ,,mr” oznacza masę całej cząsteczki kwasu. Porównaj otrzymane wyniki i sformułuj odpowiedź.