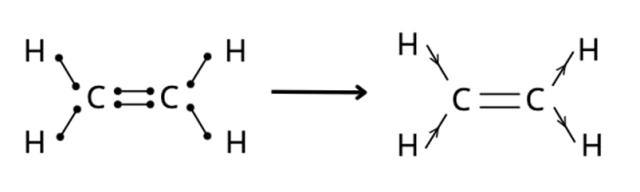
Przykładem związku, w którym wszystkie elektrony walencyjne tworzą wiązania jest CH2=CH2.

Rodzaj wiązania zależy od różnicy elektroujemności w cząsteczkach. Wartości elektroujemności zawarte są w układzie okresowym. CH2=CH2 utworzony jest przez dwa atomy węgla i cztery atomu wodoru. Atomom węgla brakuje do oktetu elektronowego po cztery elektrony, a każdemu z atomów wodoru – po jednym. Stąd dochodzi do uwspólnienia elektronów. Wiązanie między wodorem a węglem jest spolaryzowane, ponieważ różnica elektroujemności między tymi atomami mieści się w zakresie 0,4 – 1,7:
elektroujemność węgla – elektroujemność wodoru = 2,5 – 2,1 = 0,4
Wiązanie między atomami węgla jest niespolaryzowane, gdyż różnica elektroujemności jest równa zeru.
Wolne pary elektronowe są utworzone przez elektrony, które nie tworzą wiązań. W cząsteczce etenu nie ma takich elektronów.