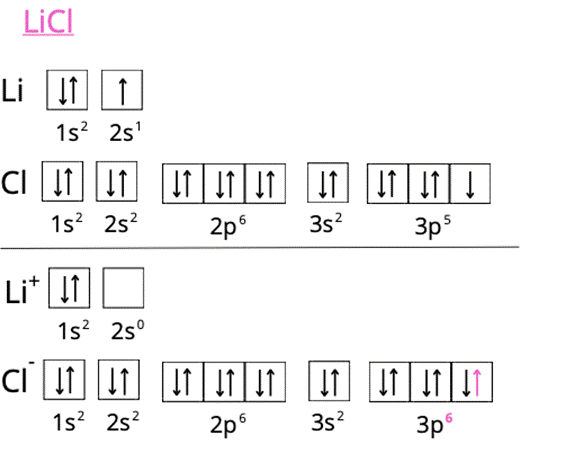
Tworzenie LiCl:
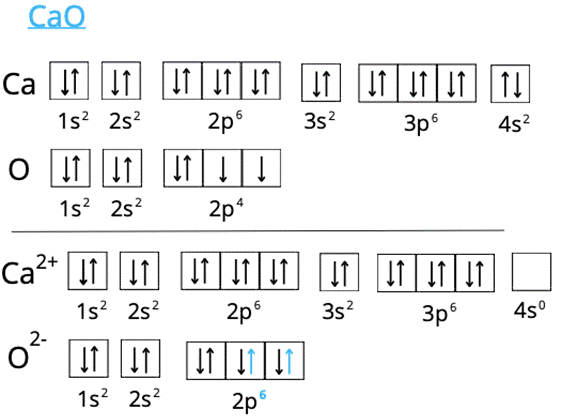
Tworzenie CaO:
Tworzenie MgF2:
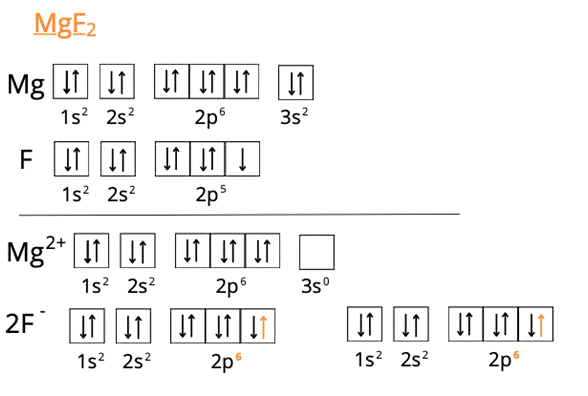
Powstałe jony uzyskują trwalsze konfiguracje elektronowe, ponieważ zyskały konfiguracje gazów szlachetnych.

W pierwszym kroku zwróć uwagę na różnicę w elektroujemności pierwiastków chemicznych. Informacje o elektroujemności znajdziesz w układzie okresowym. Różnica >1,7 wskazuje na wiązanie jonowe. Właśnie takie wiązania tworzą się w podanych przykładach. Atomy litu, wapnia i magnezu, by uzyskać trwałą konfigurację, muszą pozbyć się elektronów – lit jednego, a wapń i magnez dwóch. Przekazują je atomom chloru, tlenu i fluoru. W ten sposób wszystkie atomy w solach zyskują konfigurację gazu szlachetnego, która jest dla nich najkorzystniejsza energetycznie.