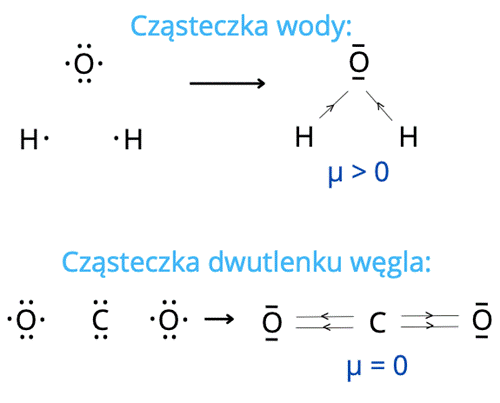

Wiązania w substancjach można określić na podstawie różnic elektroujemności pomiędzy atomami. Jeśli różnica wynosi poniżej 0,4 – jest to wiązanie kowalencyjne niespolaryzowane (inaczej atomowe). Jeśli ta różnica wynosi powyżej 1,7 – mówimy o wiązaniu jonowym. Wartości pośrednie sugerują wiązanie kowalencyjne spolaryzowane. Elektroujemność dla atomu tlenu jest równa 3,5, dla atomu węgla 2,5, a dla atomu wodoru 2,1. Przykładami cząsteczek z pożądanym wiązaniem są zatem H2O i CO2. Moment dipolowy to taka wartość fizyczna, która jest charakterystyczna dla związków z wiązaniem kowalencyjnym spolaryzowanym. Wynika z różnicy elektroujemności i przesunięcia pary elektronowej do atomu pierwiastka bardziej elektroujemnego. Jednak niektóre związki, mimo takich wiązań, nie wykazują momentu dipolowego. Wynika to z tego, że momenty dipolowe części wiązań równoważą się ze sobą przez przeciwne zwroty. Jest tak między innymi w takich związkach jak: CO2, CCl4 czy SiF4.