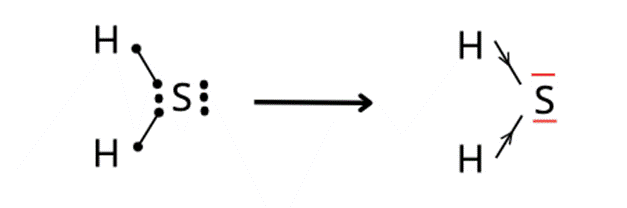
H2S posiada dwie wolne pary elektronowe. W cząsteczce tej występują wiązania kowalencyjne spolaryzowane.

Rodzaj wiązania zależy od różnicy elektroujemności w cząsteczkach. Wartości elektroujemności zawarte są w układzie okresowym. H2S utworzony jest przez atom siarki i dwa atomu wodoru – między tymi pierwiastkami tworzą się wiązania kowalencyjne spolaryzowane. Atomowi siarki brakuje do oktetu elektronowego dwóch elektronów, a każdemu z atomów wodoru – po jednym elektronie do dubletu. Stąd dochodzi do uwspólnienia elektronów. Wiązanie jest spolaryzowane, ponieważ różnica elektroujemności między siarką a wodorem mieści się w zakresie 0,4 – 1,7:
elektroujemność siarki – elektroujemność wodoru = 2,5 – 2,1 = 0,4
Wolne pary elektronowe są utworzone przez elektrony, które nie tworzą wiązań. Na rysunku zaznaczono je na czerwono.