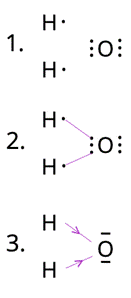
W cząsteczce wody obecne są dwa wiązania kowalencyjne spolaryzowane pomiędzy atomami wodoru i tlenu. Polaryzacja wiązania jest efektem różnicy elektroujemności między atomami, która wynosi 1,4. Atom wodoru ma jeden elektron walencyjny, więc do dubletu brakuje mu jednego. Atom tlenu ma sześć elektronów walencyjnych, więc do oktetu brakuje mu dwóch. W tym przypadku dochodzi do uwspólnienia elektronów pomiędzy atomami, co pozwala atomom wodoru na uzyskanie dubletów, a atomowi tlenu – oktetu. W cząsteczce wody są dwa pojedyncze wiązania.

W pierwszym kroku spójrz na wzór cząsteczki wody – H2O. Zapisz elektrony walencyjne. Następnie połącz elektrony tak, by atomy wodoru miały ich po dwa, atom tlenu – osiem. Powstaną w ten sposób dwa wiązania. Są one kowalencyjne spolaryzowane, ponieważ elektroujemność wodoru wynosi 2,1, a tlenu – 3,5. Różnica wynosi zatem 1,4. Jeśli różnica wynosi poniżej 0,4 – jest to wiązanie kowalencyjne niespolaryzowane (inaczej atomowe). Jeśli ta różnica wynosi powyżej 1,7 – mówimy o wiązaniu jonowym. Wartości pośrednie sugerują wiązanie kowalencyjne spolaryzowane.