Przykładem związku, w którym wszystkie elektrony walencyjne tworzą wiązania jest Na2SO4.

W cząsteczce kwasu pomiędzy atomami sodu i tlenu oraz tworzą się wiązania jonowe. Wynika to z różnicy elektroujemności, która przekracza 1,7:
elektroujemność tlenu – elektroujemność sodu = 3,5 – 0,9 = 2,6 – atomy sodu stają się w ten sposób kationami.
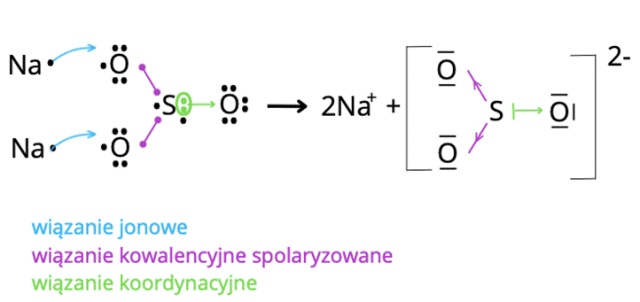
Pomiędzy atomami tlenu a atomami siarki dochodzi do uwspólnienia elektronów i powstają dwa wiązania kowalencyjne spolaryzowane. Są one spolaryzowane, ponieważ różnica elektroujemności mieści się w przedziale 0,4-1,7:
elektroujemność tlenu – elektroujemność siarki = 3,5 – 2,5 = 1
Wiązanie koordynacyjne to takie, w którym para elektronów wiązaniu pochodzi od tylko jednego atomu. Dawca pary to donor (tu: siarka), a biorca to akceptor (tu: tlen). Donor musi mieć utworzoną trwałą konfigurację elektronową i dodatkową wolną parę elektronów, by przekazać ją akceptorowi.
W ten sposób siarka może stać się donorem wolnych par elektronowych dla atomu tlenu. Wolna para elektronowa ulega uwspólnieniu.