W tym zadaniu oblicz liczbę moli powietrza w oponie samochodu o objętości V = 26 dm3 w temperaturze T1 = 17oC, jeśli manometr wskazuje ciśnienie powietrza pm = 2,5 bar. Ciśnienie atmosferyczne wynosi pat = 1000 hPa.
Korzystamy z równania Clapeyrona:
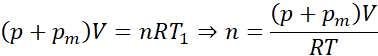
Podstawiając wartości liczbowe:
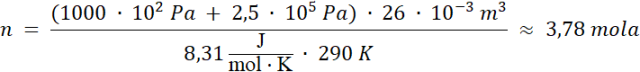
Odpowiedź: W oponie znajduje się około 3,78 mola powietrza.

Korzystamy z równania Clapeyrona, gdzie ciśnienie wewnątrz opony jest równe sumie ciśnienia atmosferycznego i zmierzonego manometrem. 1 bar = 105 Pa.

Przykład Przykład 1.
75Przykład Przykład 2.
76Przykład Przykład 3.
79Przykład Przykład 4.
81Przykład Przykład 5.
83Przykład Przykład 6.
84Zadanie 8.1.3.
86Zadanie 8.1.4.
87Zadanie 8.1.5.
87Zadanie 8.1.6.
87Zadanie 8.1.8.
88Zadanie 8.1.9.
89Zadanie 8.1.10.
89Zadanie 8.1.15.
90Zadanie 8.1.21.
91Zadanie 8.1.24.
91Zadanie 8.1.25.
92Zadanie 8.1.28.
92Zadanie 8.1.30.
93Zadanie 8.1.33.
93Przykład Przykład 1.
94Przykład Przykład 2.
95Przykład Przykład 3.
97Zadanie 8.2.5.
99Zadanie 8.2.8.
100Zadanie 8.2.11.
100Zadanie 8.2.13.
100Zadanie 8.2.14.
101Zadanie 8.2.15.
101Przykład Przykład 3.
103Przykład Przykład 4.
106Zadanie 8.3.7.
108Zadanie 8.3.9.
109Zadanie 8.3.10.
109Zadanie 8.3.11.
109Przykład Przykład
110Zadanie 8.4.2.
112Przykład Przykład. Balon
116Zadanie Zadanie 1. Cykl przemian
118Zadanie Zadanie 2. Silnik spalinowy
118Zadanie Zadanie 3. Cząsteczki gazu
119
