W tym zadaniu oblicz masę azotu w cylindrze przy ciśnieniu p = 1013 hPa. Przyjmij masę molową azotu ![]()
![]()
Korzystamy z równania Clapeyrona, a liczbę moli gazu zapisujemy jako iloraz jego masy i masy molowej:
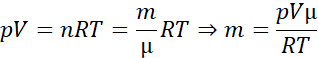
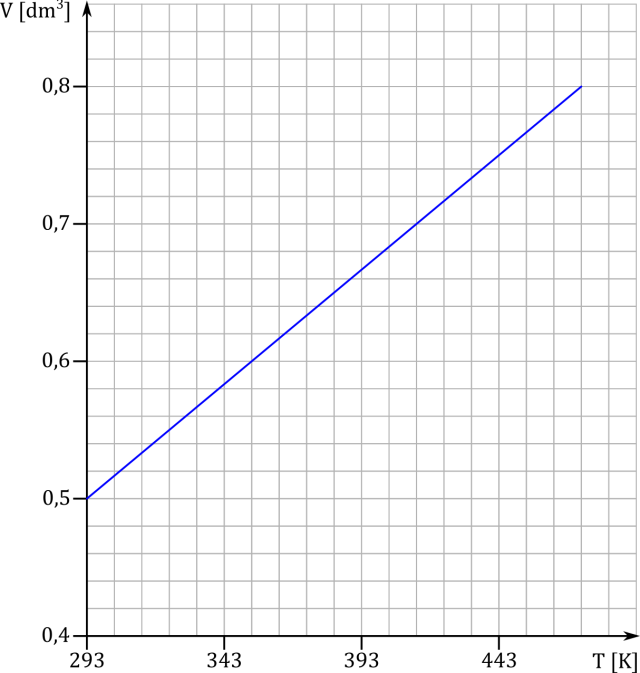
Jako objętość i temperatury używamy przyrostów objętości i temperatury odczytanych z wykresu:
![]()
Podstawiamy dane liczbowe:
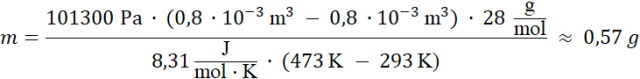
Odpowiedź: Gaz w cylindrze ma masę około 0,57 g.

Korzystamy z równania Clapeyrona, gdzie liczbę moli gazu wyrażamy jako iloraz jego masy i masy molowej. Żeby otrzymać średnią masę, zamiast objętość i temperatury używamy zmiany objętości i temperatury odczytanych z wykresu, czyli różnicy końcowych i początkowych wartości.

Przykład Przykład 1.
75Przykład Przykład 2.
76Przykład Przykład 3.
79Przykład Przykład 4.
81Przykład Przykład 5.
83Przykład Przykład 6.
84Zadanie 8.1.3.
86Zadanie 8.1.4.
87Zadanie 8.1.5.
87Zadanie 8.1.6.
87Zadanie 8.1.8.
88Zadanie 8.1.9.
89Zadanie 8.1.10.
89Zadanie 8.1.15.
90Zadanie 8.1.21.
91Zadanie 8.1.24.
91Zadanie 8.1.25.
92Zadanie 8.1.28.
92Zadanie 8.1.30.
93Zadanie 8.1.33.
93Przykład Przykład 1.
94Przykład Przykład 2.
95Przykład Przykład 3.
97Zadanie 8.2.5.
99Zadanie 8.2.8.
100Zadanie 8.2.11.
100Zadanie 8.2.13.
100Zadanie 8.2.14.
101Zadanie 8.2.15.
101Przykład Przykład 3.
103Przykład Przykład 4.
106Zadanie 8.3.7.
108Zadanie 8.3.9.
109Zadanie 8.3.10.
109Zadanie 8.3.11.
109Przykład Przykład
110Zadanie 8.4.2.
112Przykład Przykład. Balon
116Zadanie Zadanie 1. Cykl przemian
118Zadanie Zadanie 2. Silnik spalinowy
118Zadanie Zadanie 3. Cząsteczki gazu
119
