Jaką objętość zajmuje 5 moli cząsteczek tlenu w T = 20°C i pod ciśnieniem 1015 hPa?


1. Aby rozwiązać tego typu zadania, musimy skorzystać z równania Clapeyrona. Równanie to obrazuje zależności między ilością gazu (w molach), objętością a warunkami (ciśnieniem i temperaturą):
p ∙ V = n ∙ R ∙ T, gdzie:
n — liczba moli gazu
P — ciśnienie [hPa]
V — objętość [dm3]
R — stała gazowa
T — temperatura [K]
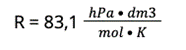
2. Musimy dopasować jednostki do tych, które potrzebne są we wzorze. Stąd temperaturę w stopniach Celsjusza należy przeliczyć na temperaturę w Kelwinach (0 stopni Celsjusza = 273 K).
T = 20°C = 293 K
3. Wszystkie dane podstawiamy do wzoru i rozwiązujemy równanie.
pV = nRT
1015 ∙ V = 5 ∙ 83,1 ∙ 293
1015 ∙ V = 121741,5 | : 1015
V = 119,9 [dm3]

Zadanie 2
57Zadanie 5
106Zadanie 8
108Zadanie 11
108Zadanie 3a
109Zadanie 6a
109Zadanie 7a
109Zadanie 1
110Zadanie 1a
113Zadanie 4
116Zadanie 2a
117Ćwiczenie 1
121Ćwiczenie 2
125Ćwiczenie 4
125Ćwiczenie 6
125Zadanie 1a
125Zadanie 2a
125Zadanie 4a
126Zadanie 1
134Zadanie 2
134Zadanie 3
134Zadanie 4
134Zadanie 5
135Zadanie 6
135Zadanie 7
135Zadanie 9
135Zadanie 12
135Zadanie 14
135Zadanie 15
135Zadanie 20
136
