Jaka jest objętość 20 milimoli wodoru w temperaturze 295 K oraz pod ciśnieniem 1020 hPa?


1. Aby rozwiązać tego typu zadania, musimy skorzystać z równania Clapeyrona. Równanie to obrazuje zależności między ilością gazu (w molach), objętością a warunkami (ciśnieniem i temperaturą):
p ∙ V = n ∙ R ∙ T, gdzie:
n — liczba moli gazu
P — ciśnienie [hPa]
V — objętość [dm3]
R — stała gazowa
T — temperatura [K]
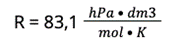
2. Milimole należy przeliczyć na mole.
1 mmol — 0,001 mol
20 mmol — x
x = 20 ∙ 0,001 : 1 = 0,02 [mol]
3. Wszystkie dane podstawiamy do równania i rozwiązujemy je.
pV = nRT
1020 ∙ V = 0,02 ∙ 83,1 ∙ 295
1020 ∙ V = 490,29 / : 1020
V = 0,48 [dm3]

Zadanie 2
57Zadanie 5
106Zadanie 8
108Zadanie 11
108Zadanie 3a
109Zadanie 6a
109Zadanie 7a
109Zadanie 1
110Zadanie 1a
113Zadanie 4
116Zadanie 2a
117Ćwiczenie 1
121Ćwiczenie 2
125Ćwiczenie 4
125Ćwiczenie 6
125Zadanie 1a
125Zadanie 2a
125Zadanie 4a
126Zadanie 1
134Zadanie 2
134Zadanie 3
134Zadanie 4
134Zadanie 5
135Zadanie 6
135Zadanie 7
135Zadanie 9
135Zadanie 12
135Zadanie 14
135Zadanie 15
135Zadanie 20
136
