

1. Aby rozwiązać tego typu zadania, musimy skorzystać z równania Clapeyrona. Równanie to obrazuje zależności między ilością gazu (w molach), objętością a warunkami (ciśnieniem i temperaturą):
p ∙ V = n ∙ R ∙ T, gdzie:
n — liczba moli gazu
P — ciśnienie [hPa]
V — objętość [dm3]
R — stała gazowa
T — temperatura [K]
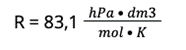
2. Azot w gramach należy przeliczyć na mole. Pamiętaj, że azot występuje w cząsteczkach dwuatomowych, więc jedna cząsteczka azotu waży tyle, co 2 atomy azotu. Znając masę jednego mola azotu, obliczamy, ile moli stanowi 140 g.
mN = 14 g/mol → mN2 = 28 g/mol
1 mol — 28 g
x — 140 g
x = 140 ∙ 1 : 28 = 5 [moli]
3. Wszystkie dane podstawiamy do równania i rozwiązujemy je.
pV = nRT
1020 ∙ V = 0,02 ∙ 0,45 ∙ 295
1020 ∙ V = 11031,5 / : 1020
V = 10,81 [dm3]
pV = nRT
1020 ∙ V = 5 ∙ 83,1 ∙ 295
1020 ∙ V = 122572,5 / : 1020
V = 120,17 [dm3]