Twoim zadaniem jest obliczenie stosunku stężeń jonów wodorowych w kawie oraz soku z cytryny, wiedząc, że pH kawy jest dwa razy większe niż pH soku cytrynowego. Kwasowość roztworu mierzy się za pomocą współczynnika pH, który oblicza się ze wzoru:
współczynnik pH = – log s,
w którym s oznacza stężenie jonów wodorowych w roztworze (w molach/dm3). Woda destylowana jest neutralna, co oznacza, że jej współczynnik pH wynosi 7.
x -pH soku z cytryny
![]()
![]()
![]()
2x -pH kawy
![]()
![]()
![]()
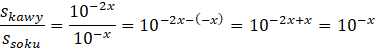
Z tabelki odczytujesz, że pH soku z cytryny wynosi 2,5, czyli x = 2,5.
![]()

Aby obliczyć stosunek stężenia jonów wodorowych w soku z cytryny oznacz za pomocą x pH tego soku. Otrzymujesz proste równania logarytmiczne. Pomnóż obie strony przez -1, aby otrzymać sam logarytm.
![]()
![]()
Aby je rozwiązać korzystasz z definicji logarytmu. Logarytm to potęga, do której musisz podnieść podstawę, aby dostać liczbę logarytmowaną. Jeśli znasz wartość logarytmu, ale nie wiesz, ile wynosi liczba logarytmowana, to tę liczbę obliczasz przez podniesienie podstawy do wartości logarytmu. Pamiętaj, że jeśli w logarytmie nie jest zapisana podstawa, to wynosi ona 10.
![]()
Dostaniesz wartość stężenia jonów wodorowych w zależności od x. Postąp podobnie dla kawy. Z treści zadania wynika, że pH kawy jest dwa razy większe niż soku z cytryny, więc oznacz je przez 2x.
![]()
![]()
![]()
Aby obliczyć ich stosunek podziel je przez siebie.
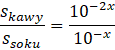
Następnie skorzystaj z własności dzielenia potęg o tej samej podstawie (odejmij od siebie wykładniki).
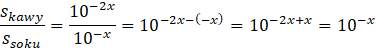
Dostaniesz wartość szukanego stosunku w zależności od x, którym jest pH soku z cytryny. Aby dostać konkretną wartość liczbową podstaw za x odczytaną z tabeli wartość pH.
![]()

Zadanie 16.
89Zadanie 17.
90Zadanie 18.
90Zadanie 25.
98Zadanie 27.
98Zadanie 16.
103Zadanie 17.
103Zadanie 19.
103Zadanie 14.
111Zadanie 13.
114Zadanie 14.
114Zadanie 21.
131Zadanie 23.
137Zadanie 28.
138Zadanie 20.
142Zadanie 23.
148
